
分析 (1分别根据n=$\frac{m}{M}$计算出氢气、氯气的物质的量,再根据V=nVm计算出标况下混合气体的体积;
(2)根据反应方程式H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl计算出剩余气体体积.
解答 解:(1)0.8g氢气的物质的量为:$\frac{0.8g}{2g/mol}$=0.4mol,
14.2g氯气的物质的量为:$\frac{14.2g}{71g/mol}$=0.2mol,
混合气体的总物质的量为:0.4mol+0.2mol=0.6mol,
标况下0.6mol混合气体的体积为:22.4L/mol×0.6mol=13.44L,
答:最初混合气体在标准状况下的体积为13.44L;
(2)根据反应方程式H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl可知,0.2mol氯气完全反应消耗氢气的物质的量为:0.2mol,
则反应后氢气有剩余,剩余氢气的物质的量为:0.4mol-0.2mol=0.2mol,标况下0.2mol氢气的体积为:22.4L/mol×0.2mol=4.48L,
答:最后残留的气体为氢气,剩余的氢气在标况下的体积为4.48L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应方程式为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积等物理量之间的转化关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是化合物,钙、铁则分别是Ca2+和Fe3+ | |
| C. | 发生地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 | |
| D. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁等还原性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
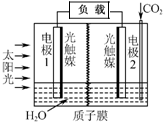 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:| A. | 电极1周围pH增大 | |
| B. | 电子由电极1经过负载流向电极2 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )| A. | 简单离子的半径:X3+>Z3- | |
| B. | 元素Z的最外层电子可能为6 | |
| C. | 元素Y的最高价氧化物的水化物可能是强酸 | |
| D. | 元素W的最高价氧化物的水化物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).
Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).| 气化炉 | 燃烧炉 |
| ①C(s)+H2O(g)?CO(g)+H2(g)△H=+131.6kJ•mol-1 ②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1 ③CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ•mol-1 | ④C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 ⑤CaCO3(s)?CaO(s)+CO2(g) K |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| T1 | 0 | 1.5 | 2.3 | 4.0 | 4.0 | 4.0 |
| T2 | 0 | 1.0 | 1.8 | 2.8 | 3.1 | 3.1 |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| p1 | 1 | 0.90 | 0.83 | 0.75 | 0.75 | 0.75 |
| p2 | 1 | 0.58 | 0.35 | 0.31 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
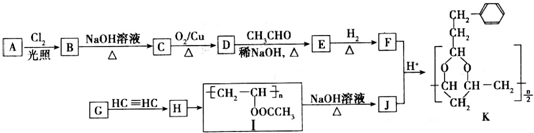
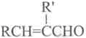 +H2O(R,R′表示烃基或氢)
+H2O(R,R′表示烃基或氢)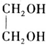 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$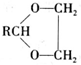 +H2O
+H2O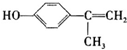 (写结构简式).
(写结构简式).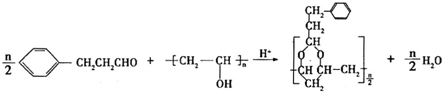 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
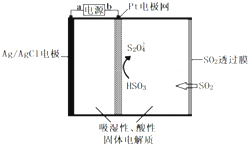
| A. | b为电源的正极 | |
| B. | 负极反应式 Ag-e-+Cl-═AgCl | |
| C. | 当电路中电子转移为5×10-5 mol时,进入传感器的SO2为 1.12 mL | |
| D. | 阴极的电极反应式是:2HSO3-+2H++2e-═S2O42-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com