
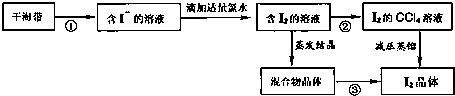
| 名称 | 普通漏斗 | 长颈漏斗 | 侧底烧瓶 | 蒸发皿 | 研钵 | 坩埚 | 烧杯 |
| 仪器 |  |
 |
 |
 |
 |
 |
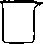 |
| 编号 | A | B | C | D | E | F | G |
 ,故答案为:
,故答案为: .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、3.38g |
| B、4.58g |
| C、4.16g |
| D、4.41g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内生成2n mol AB同时消耗n mol B2 |
| B、单位时间总物质的量不随时间的变化而变化 |
| C、单位时间内生成n mol A2同时消耗n mol B2 |
| D、容器内各组分的物质的量不随时间的变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯化硼(BN)晶体是一种新型无机合成材料.用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+2CO(NH2)2=4BN+Na2O+4H2O+2CO2↑
氯化硼(BN)晶体是一种新型无机合成材料.用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+2CO(NH2)2=4BN+Na2O+4H2O+2CO2↑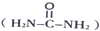 )中π键与σ键数目之比为
)中π键与σ键数目之比为查看答案和解析>>
科目:高中化学 来源: 题型:
 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| H2O | CO | CO2 | H2 | |
| 甲 (质量/g) | 1.8 | 8.4 | a | 1 |
| 乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||
| d | f | g | |||||
| b | c | e | h | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)研究硫及其化合物性质有重要意义.
(1)研究硫及其化合物性质有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com