
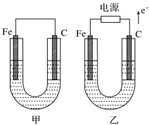
 如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题.
如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题.分析 (1)甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②甲中碳为正极,氧气得电子生成氢氧根,乙中碳为阳极,发生氧化反应;
③根据得失电子数相等确定生成物,再根据反应物和生成物写出反应方程式.
解答 解:(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
②甲中碳为正极,氧气得电子生成氢氧根,电极反应为2H2O+O2+4e-═4OH-,乙中碳为阳极,发生氧化反应;
故答案为:2H2O+O2+4e-═4OH-;氧化反应;
③过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl.
点评 本题考查原电池和电解原理,明确工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
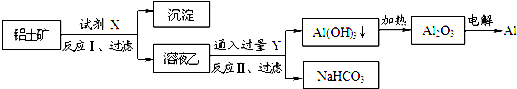
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
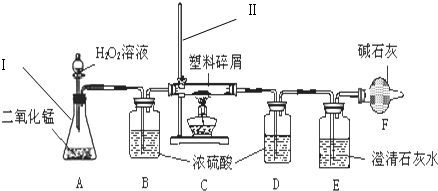
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 假 设 | 操作 | 现 象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中,滴加 紫色石蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S 为 +3 价,具有较强 的还原性. | 取少量溶液于试管中,滴加过量新制氯水,再 滴加 BaCl2 溶液 | 有白色沉淀生 成 | 该反应的离子方程式依次为: 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L H2中含有的原子数为NA个 | |
| B. | 0.012kgC-14中约含有6.02×1023个碳原子 | |
| C. | 18g H2O中含有电子数为3NA个 | |
| D. | NA个氧气分子和NA个氢气分子的质量比等于16:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①中阳极处能产生使湿润淀粉KI试纸变蓝的气体 | |
| B. | ②中待镀铁制品应与电源正极相连 | |
| C. | ③中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法 | |
| D. | ④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com