
 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.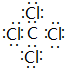
分析 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上,则X为C元素,m为C2H2;Y2-的M能层的原子轨道为全空状态,Y原子核外电子数为2+8-2=6,故Y为O元素;Z的单质用作铝热反应的引燃剂,则Z为Mg. 化合物ZW2的晶体为离子晶体,W为-价,W与X形成的化合物是一种常见的有机溶剂n,则W为Cl,n为CCl4;A为第四周期元素,其基态原子含有6个未成对电子,核外电子排布为1s22s22p63s23p63d54s1,故A为Cr,据此解答.
解答 解:X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上,则X为C元素,m为C2H2;Y2-的M能层的原子轨道为全空状态,Y原子核外电子数为2+8-2=6,故Y为O元素;Z的单质用作铝热反应的引燃剂,则Z为Mg.化合物ZW2的晶体为离子晶体,W为-价,W与X形成的化合物是一种常见的有机溶剂n,则W为Cl,n为CCl4;A为第四周期元素,其基态原子含有6个未成对电子,核外电子排布为1s22s22p63s23p63d54s1,故A为Cr.
(1)m为C2H2,其结构式为H-C≡C-H,分子中C的原子成2个σ键,没有孤对电子,C原子采取sp杂化,故答案为:sp;
(2)A为Cr元素,处于周期表中第四周期VIB族,Cr原子核外电子排布为1s22s22p63s23p63d54s1,Cr3+的外围电子排布式是3d3,
故答案为:第四周期VIB族;3d3;
(3)W(Cl)的含氧酸中酸性最弱为HClO,氧原子形成成2个σ键,有2对孤对电子,分子其构型是V形,
故答案为:V形;
(4)n为CCl4,电子式为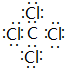 ,故答案为:
,故答案为: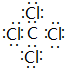 ;
;
(5)①MgCl2属于离子晶体,②MgO属于离子晶体,氧离子所得电荷比较氯离子多,且氧离子比较小于氯离子,故MgO的晶格能更大,故熔点MgO>MgCl2,③有机溶剂CCl4,形成分子晶体,④X原子形成的一种硬度最大的单质为金刚石,属于原子晶体,一般熔沸点:原子晶体>离子晶体>分子晶体,故熔点由高到低的顺序排列:④>②>①>③,
故答案为:④>②>①>③;
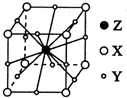
(6)晶胞中碳原子数目为8×$\frac{1}{8}$=1,氧原子数目为12×$\frac{1}{4}$=3,Mg原子数目为1,故该化合物化学式为MgCO3,
故答案为:MgCO3;
(6)将氨气通入含Cr2O72-的酸性溶液,可生成一种无色无味无污染的气体,该气体为氮气,N元素发生氧化反应,则Cr2O72-发生还原反应生成Cr3+,该反应离子方程式是:2NH3+Cr2O72-+8H+=2Cr3++N2↑7H2O,故答案为:2NH3+Cr2O72-+8H+=2Cr3++N2↑7H2O.
点评 本题是对物质结构的考查,涉及元素化合物推断、核外电子排布、电子式、晶胞计算、杂化轨道与空间构型判断、晶体类型与性质、氧化还原反应方程式书写等,需要学生具备扎实的基础,难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列离子方程式正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO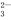 ===CO2↑+H2O
===CO2↑+H2O
B.氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
C.氯化铝溶液加入氨水:Al3++3OH-===Al(OH)3↓
D.用氢氧化钠检验氯化铵溶液中铵根离子:NH +OH―
+OH― NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、O2完全转化为SO3 | B. | SO2、O2、SO3的浓度均不再变化 | ||
| C. | SO2、O2、SO3的浓度一定相等 | D. | 正、逆反应速率相等且等于零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热法除去NaOH固体中混有的NH4Cl固体. | |
| B. | 向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 | |
| C. | SO2能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| D. | 向水玻璃中滴加盐酸制备硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
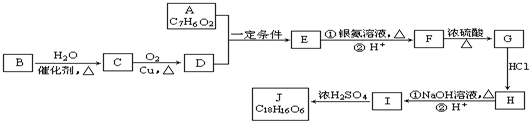
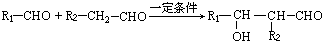
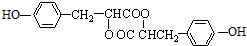 .
.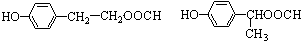 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
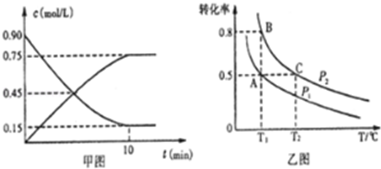
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com