
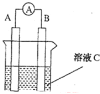
����Ŀ����1����ͼ��ʾ����CΪŨ���ᣬ������ָ�뷢��ƫת��B�缫����ΪFe ,A�缫����ΪCu����B�缫�ĵ缫��ӦʽΪ______________��A�缫�ĵ缫��ӦʽΪ ����Ӧ����һ��ʱ�����ҺC��pH�� (����ߡ������͡��������䡱)��
��2���ҹ��״�����������ˮ�����Ϊ��Դ�����͵ĺ�ˮ��־�ƣ��Ժ�ˮΪ�������Һ���������е�����ʹ����������������������ֻҪ�ѵƷ��뺣ˮ�����ӣ��ͻᷢ��ҫ�۵İ⡣���Դ�ĸ���������________��������ӦΪ___________��������ӦΪ_______________________��
��3�����ε�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ� ����Li2CO3��Na2CO3�������λ����������ʣ�COΪ����ȼ����������CO2�Ļ����Ϊ������ȼ�����Ƶ���650 ���¹�����ȼ�ϵ�أ�����йص�ط�Ӧʽ��������ӦʽΪ2CO��2CO32��4e��=4CO2��������ӦʽΪ________________________������ܷ�ӦʽΪ_________________________��
���𰸡���1��4H++ 2NO3-+2e-=2NO2+2H2O Cu-2e-= Cu2+ ����
��2���� 4Al��12e��=4Al3�� 3O2��6H2O��12e��=12OH��
��3��O2��2CO2��4e��=2CO![]() 2CO��O2===2CO2(2��)
2CO��O2===2CO2(2��)
��������
�����������1����CΪŨ���ᣬ����������Ũ����ۻ������ܼ�����Ӧ������ʱ������ָ�뷢��ƫת��B�缫����Ϊ���� ,A�缫����CuΪ�����������缫��ӦΪCu-2 e-= Cu2+��������ӦΪ4H++ 2NO3-+2e-=2NO2+2H2O����Ӧһ��ʱ�����ҺpH�����ߡ�
��2����������ˮ�����Ϊ��Դ�����ͺ�ˮ��־�ƣ�AlΪ����������������Ӧ��4Al-12e-=4Al3+�������е�����Ϊ��������������Ϊʯī���õ缫�Ϸ�����ԭ��Ӧ��3O2+6H2O+12e-�T12OH-��
��3����������ȼ�ϵ���У������������õ��ӺͶ�����̼��Ӧ����̼������ӣ��缫��ӦʽΪO2+2CO2+4e-�T2 CO32-��������ȼ��COʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼���缫��ӦʽΪ2CO+2 CO32--4e-�T4CO2���ڵ�ʧ������ͬ�����½��������缫��Ӧʽ��ӵõ�ط�Ӧʽ2CO+O2�T2CO2��


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����
A��5.6 g Fe��������������ȫ��Ӧʧȥ������Ϊ0.2NA
B����״���£�11.2L CCl4�����ķ�����Ϊ0.5NA
C��0.5 molL��1AlCl3��Һ��Cl������ĿΪ1.5NA
D��17g�����к��еĵ�����Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��1mol�������������22.4L
B��1molH2 ��������1g������ռ�������22.4L
C���ڱ�״���£�1mol�κ�������ռ�������ԼΪ22.4L
D���ڱ�״���£�1mol�κ�������ռ�������ԼΪ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����ش��������⣺
��1������˵����ȷ����__________(����ĸ���)��
A������Na2SO4����ʹ��Һ��a��䵽b��
B��ͨ����������ʹ��Һ��d��䵽c��
C��d����BaSO4��������
D��a���Ӧ��Ksp����c���Ӧ��Ksp
��2����100 mL 1 mol��L��1 H2SO4����100 mL��Ba2�� 0.137 g ����Һ�г�ַ�Ӧ���˳���������Һ�в�����Ba2�������ʵ���Ũ��Ϊ____________(������λ��Ч����)��
��3����������100 mL��ˮ��100 mL 0.01 mol��L��1��H2SO4�ֱ�ϴ�ӣ������������ʧ��BaSO4������֮��Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���32He��˵����ȷ����
A. 32Heԭ�Ӻ��ں���2������
B. 32Heԭ�Ӻ��ں���3������
C. 32Heԭ�Ӻ�����3������
D. 32He��42He�����ֲ�ͬ�ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������г����¼�����NaOH��Һ��Ӧ�����������ᷴӦ������������
A��Mg
B��Cl2
C��Si
D��Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������̼ԭ�ӳɼ��ص����(����)
A����ʧȥ�����ĵ����γ�����
B������������������ԭ�ӵ��������γɹ��õ��Ӷ�
C���ܹ��γɵ�����˫���������ȶ��ֳɼ���ʽ
D��ÿ��̼ԭ�����������ԭ���γ�4�����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�������֪���±�����(25 ��)��
��ѧʽ | ����ƽ�ⳣ�� |
HCN | K��4.9��10��10 |
CH3COOH | K��1.8��10��5 |
H2CO3 | K1��4.4��10��7��K2��4.7��10��11 |
��1��25 ��ʱ����Ũ�ȵ�������Һ(A��NaCN��Һ��B��Na2CO3��Һ��C��CH3COONa��Һ)��pH�ɴ�С��˳��Ϊ__________________________��(��д���)
��2��25 ��ʱ����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ______ ___��
��3������Ũ��Ϊ0.02 mol/L��HCN��0.01mol/L NaOH�������Ϻ��c(Na+)��c(CN-)�����й�ϵ��ȷ���� ��
A��c(H+)��c(OH-) B��c(H+)��c(OH-)
C��c(H+)+c(HCN) = c(OH-) D��c(HCN)+ c(CN-)=0.01mol/L
��4��Ũ��Al2(SO4)3��Һ��Ũ��С�մ�(NaHCO3)��Һ��Ͽ�����������������ӷ�Ӧ����ʽ��ʾ����ԭ��_____________________��
��5����֪NaHC2O4ˮ��Һ�����ԣ���д������Һ�и�����Ũ�ȵĴ�С___________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com