
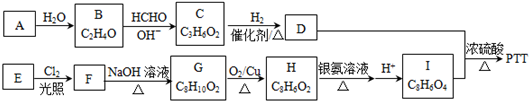
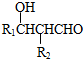
 £®
£® £®
£® £®
£®·ÖĪö øł¾ŻĢāøųŠÅĻ¢ÖŖ£¬BĪŖČ©£¬½į¹¹¼ņŹ½ĪŖCH3CHO£¬A·¢Éś¼Ó³É·“Ӧɜ³ÉB£¬AĪŖHC”ŌCH£¬CĪŖHOCH2CH2CHO£¬CŗĶĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉD£¬D½į¹¹¼ņŹ½ĪŖHOCH2CH2CH2OH£»
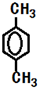
·¼ĻćĢžEµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ106£¬ÉčĘä·Ö×ÓŹ½ĪŖCnH2n-6£¬n=$\frac{106+6}{14}$=8£¬EµÄŅ»ĀČ“śĪļÖ»ÓŠ2ÖÖ£¬ŌņEµÄ½į¹¹¼ņŹ½ĪŖ £¬
£¬
EŗĶĀČĘųŌŚ¹āÕÕĢõ¼žĻĀ·¢ÉśČ”“ś·“Ӧɜ³ÉF£¬FŗĶĒāŃõ»ÆÄĘĖ®ČÜŅŗ·¢ÉśČ”“ś·“Ӧɜ³ÉG£¬GÄÜ·¢ÉśŃõ»Æ·“Ӧɜ³ÉH£¬ĖµĆ÷GŹĒ“¼”¢HŹĒČ©£¬H·¢ÉśŅų¾µ·“Ó¦ŗóĖį»ÆµĆµ½I£¬IŹĒōČĖį£¬ĖłŅŌFĪŖ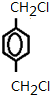 ”¢GĪŖ
”¢GĪŖ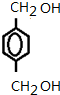 ”¢HĪŖ
”¢HĪŖ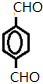 £¬IĪŖ
£¬IĪŖ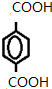 £¬DŗĶI·¢ÉśĖõ¾Ū·“Ӧɜ³Éøß·Ö×Ó»ÆŗĻĪļ£¬øß·Ö×Ó»ÆŗĻĪļĪŖ
£¬DŗĶI·¢ÉśĖõ¾Ū·“Ӧɜ³Éøß·Ö×Ó»ÆŗĻĪļ£¬øß·Ö×Ó»ÆŗĻĪļĪŖ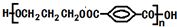 £¬¾Ż“Ė·ÖĪö½ā“š£®
£¬¾Ż“Ė·ÖĪö½ā“š£®
½ā“š ½ā£ŗøł¾ŻĢāøųŠÅĻ¢ÖŖ£¬BĪŖČ©£¬½į¹¹¼ņŹ½ĪŖCH3CHO£¬A·¢Éś¼Ó³É·“Ӧɜ³ÉB£¬AĪŖHC”ŌCH£¬CĪŖHOCH2CH2CHO£¬CŗĶĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉD£¬D½į¹¹¼ņŹ½ĪŖHOCH2CH2CH2OH£»
·¼ĻćĢžEµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ106£¬ÉčĘä·Ö×ÓŹ½ĪŖCnH2n-6£¬n=$\frac{106+6}{14}$=8£¬EµÄŅ»ĀČ“śĪļÖ»ÓŠ2ÖÖ£¬ŌņEµÄ½į¹¹¼ņŹ½ĪŖ £¬
£¬
EŗĶĀČĘųŌŚ¹āÕÕĢõ¼žĻĀ·¢ÉśČ”“ś·“Ӧɜ³ÉF£¬FŗĶĒāŃõ»ÆÄĘĖ®ČÜŅŗ·¢ÉśČ”“ś·“Ӧɜ³ÉG£¬GÄÜ·¢ÉśŃõ»Æ·“Ӧɜ³ÉH£¬ĖµĆ÷GŹĒ“¼”¢HŹĒČ©£¬H·¢ÉśŅų¾µ·“Ó¦ŗóĖį»ÆµĆµ½I£¬IŹĒōČĖį£¬ĖłŅŌFĪŖ ”¢GĪŖ
”¢GĪŖ ”¢HĪŖ
”¢HĪŖ £¬IĪŖ
£¬IĪŖ £¬DŗĶI·¢ÉśĖõ¾Ū·“Ӧɜ³Éøß·Ö×Ó»ÆŗĻĪļ£¬øß·Ö×Ó»ÆŗĻĪļĪŖ
£¬DŗĶI·¢ÉśĖõ¾Ū·“Ӧɜ³Éøß·Ö×Ó»ÆŗĻĪļ£¬øß·Ö×Ó»ÆŗĻĪļĪŖ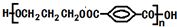 £¬
£¬
£Ø1£©ĶعżŅŌÉĻ·ÖĪöÖŖ£¬BĪŖCH3CHO£¬CĪŖHOCH2CH2CHO£¬CÖŠ¹ŁÄÜĶÅŹĒČ©»łŗĶōĒ»ł£¬
¹Ź“š°øĪŖ£ŗCH3CHO£»-CHO”¢-OH£»
£Ø2£©DĪŖHOCH2CH2CH2OH£¬ĘäĆū³ĘŹĒ£¬¹Ź“š°øĪŖ£ŗ1£¬3-±ū¶ž“¼£»
£Ø3£©ĶعżŅŌÉĻ·ÖĪöÖŖ£¬E½į¹¹¼ņŹ½ĪŖ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£»
£Ø4£©EÉś³ÉFµÄ·“Ó¦ŹĒČ”“ś·“Ó¦£¬Éś³ÉPTTµÄ·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗČ”“ś£» £»
£»
£Ø5£©IµÄĶ¬·ÖŅģ¹¹·ūŗĻĻĀĮŠĢõ¼ž£ŗ¢Łŗ¬ÓŠ±½»·”¢¢ŚŗĖ“Ź²ÕńĒāĘ×ÓŠČżøö·å£¬ĖµĆ÷ŗ¬ÓŠČżÖÖĒāŌ×Ó£¬·ūŗĻĢõ¼žµÄĶ¬·ÖŅģ¹¹Ģå½į¹¹¼ņŹ½ĪŖ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļĶʶĻ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ·ÖĪöĶʶĻÄÜĮ¦£¬øł¾Ż·“Ó¦Ģõ¼ž½įŗĻĢāøųŠÅĻ¢½ųŠŠĶʶĻ£¬ÄѵćŹĒĶ¬·ÖŅģ¹¹ĢåÖÖĄąÅŠ¶Ļ£¬Ķ¬·ÖŅģ¹¹ĢåÓŠ¹ŁÄÜĶÅŅģ¹¹”¢Ī»ÖĆŅģ¹¹£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĒāĘų | B£® | °±Ęų | C£® | ŃõĘų | D£® | ŅŅČ² |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
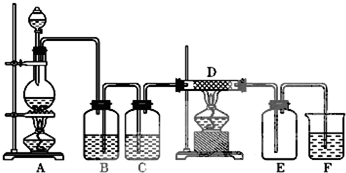
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SO2ĘÆ°×Ö½½¬ | B£® | “æ¼īĒåĻ“ÓĶĪŪ | ||
| C£® | Na2S³żĪŪĖ®ÖŠµÄCu2+ | D£® | ĘÆ°×·ŪĘÆ°×ÖÆĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČÖŹĮæµÄŅŅĻ©ŗĶ±ūĻ©ÖŠŗ¬ÓŠµÄ¹²ÓƵē×Ó¶ŌŹż | |
| B£® | µČĪļÖŹµÄĮæµÄĖ®ÓėÖŲĖ®ŗ¬ÓŠµÄÖŠ×ÓŹż | |
| C£® | Ķ¬ĪĀ”¢Ķ¬Ń¹”¢Ķ¬Ģå»żµÄCOŗĶNOŗ¬ÓŠµÄÖŹ×ÓŹż | |
| D£® | µČĪļÖŹµÄĮæµÄĢśŗĶĀĮ·Ö±šÓė×ćĮæŃĪĖįĶźČ«·“Ó¦Ź±×ŖŅʵĵē×ÓŹż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
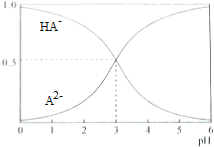
| A£® | pH=5Ź±£¬c£ØHA-£©£¾c£ØA2-£©£¾c£ØH+£©£¾c£ØOH-£© | |
| B£® | ŌŚNa2AČÜŅŗÖŠ“ęŌŚc£ØNa+£©=2c£ØA2-£©+2c£ØHA-£© | |
| C£® | µČĪļÖŹµÄĮæÅØ¶ČµÄNaHAŗĶNa2A»ģŗĻČÜŅŗÖŠ£¬c£ØNa+£©£¾c£ØA2-£©£¾c£ØHA-£© | |
| D£® | µēĄėĘ½ŗāHA-?A2-+H+µÄĘ½ŗā³£ŹżKa=10-3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĖįŠŌ£ŗH2SO3£¾H2CO3 | B£® | ČŪ·Šµć£ŗHF£¾HCl | ||
| C£® | ¼īŠŌ£ŗNaOH£¾Al£ØOH£©3 | D£® | ČČĪČ¶ØŠŌ£ŗNa2CO3£¾CaCO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
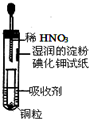
| A£® | ĪüŹÕ¼ĮæÉŅŌŹĒNaOHČÜŅŗ | B£® | ŹŌ¹ÜÉĻ²æµÄĘųĢåŹ¼ÖÕĪŖĪŽÉ« | ||
| C£® | Š”ŹŌ¹ÜÖŠČÜŅŗ×īÖÕ³ŹĄ¶É« | D£® | ŹŌÖ½ĻȱäŗģŗóĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
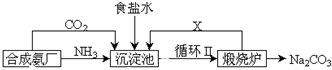
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com