
(12分)Ⅰ.将下列离子Na+、K+、Cu2+、H+、NO3﹣、Cl﹣、CO32﹣、OH﹣按可能大量共存于同一溶液的情况,把他们分成A、B两组,已知A组溶液显酸性,且每组中均含两种阳离子和两种阴离子.
A组: .
B组:
Ⅱ.写出下列过程反应的离子方程式:
(1)向澄清石灰水中滴加少量NaHCO3溶液: .
(2)向饱和Na2CO3溶液中通入足量CO2气体: .
(3)向明矾溶液中,逐滴加入Ba(OH)2溶液至SO42﹣沉淀完全: .
(4)用1L 1.0mol?L﹣1的NaOH溶液吸收0.7molCO2气体 .
(12分,每空2分)
A组:Cu2+、H+、Cl﹣、NO3﹣.
B组:Na+、K+、OH﹣、CO32﹣
Ⅱ.(1)Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O.
(2)2Na++CO32﹣+CO2+H2O=2NaHCO3↓.
(3)Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+AlO2﹣+2H2O.
(4)10OH﹣+7CO2=3CO32﹣+4HCO3﹣+3H2O.
【解析】
试题分析:I、A组呈酸性,所以A中一定含有H+,则与氢离子反应的离子CO32﹣、OH﹣在B组中,而与CO32﹣、OH﹣反应的Cu2+在A组中,所以A中的阴离子只能是NO3﹣、Cl﹣,B中的阳离子只能是Na+、K+,所以A组离子有:Cu2+、H+、Cl﹣、NO3-,B组离子有:Na+、K+、OH﹣、CO32﹣;
II、(1)向澄清石灰水中滴加少量NaHCO3溶液,则碳酸氢根离子消耗完,生成碳酸钙沉淀和水,所以离子方程式是Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O;
(2)向饱和Na2CO3溶液中通入足量CO2气体,生成的碳酸氢钠的溶解度小于碳酸钠,所以碳酸氢钠以固体形式析出,离子方程式为2Na++CO32﹣+CO2+H2O=2NaHCO3↓;
(3)根据明矾的电离方程式,可知向明矾溶液中,逐滴加入Ba(OH)2溶液至SO42﹣沉淀完全时,铝离子乙偏铝酸根离子形式存在,离子方程式为Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+AlO2﹣+2H2O ;
(4)氢氧化钠与二氧化碳的物质的量1:1时生成碳酸氢钠,2:1时生成碳酸钠,现在用1L 1.0mol?L﹣1的NaOH溶液吸收0.7molCO2气体,氢氧化钠与二氧化碳的物质的量之比是1:0.7=10:7,所以生成0.4mol碳酸氢钠和0.3 mol的碳酸钠,碳酸氢根离子与碳酸根离子的物质的量之比是0.4:0.3=4:3,所以离子方程式是10OH﹣+7CO2=3CO32﹣+4HCO3﹣+3H2O。
考点:考查离子的判断,离子方程式的书写


科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列做法或物质用途的叙述中错误的是()
A.可以以Fe2(SO4)3代替明矾作净水剂
B.给误食重金属盐的病人喝生牛奶以解毒
C.除去瓷器表面污垢可以选用热烧碱溶液
D.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:选择题
下列各图示实验设计和操作合理的是 ( )
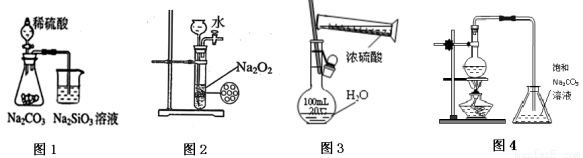
A.图1 证明非金属性强弱:S>C>Si B.图2 制备少量氧气
C.图3 配制一定物质的量浓度的硫酸溶液 D.图4 制备少量乙酸丁酯
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:填空题
(13分)原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,,N2+核外3d有9个电子,请回答下列问题:
(1)N位于元素周期表的 区,X、Y、Z的电负性最大的为 。
(2)XZ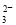 中中心原子杂化方式为 。
中中心原子杂化方式为 。
(3) Z的氢化物(H2Z)在乙醇中的溶解度大于H2M,其原因是 。
(4)Na2M2Z3还原性较强,在溶液中易被Cl2氧化成MZ ,常用作脱氯剂,该反应的离子方程式为 。
,常用作脱氯剂,该反应的离子方程式为 。
(5)N与Y可形成的一种具有良好的电学和光学性能的化合物,其晶胞结构如图所示,则该化合物的化学式为 。

查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:选择题
下列有关化学与生活说法中,不正确的是
A. 是世界通用的循环再生标志,简称回收标志
是世界通用的循环再生标志,简称回收标志
B.大量生产聚乙烯、聚氯乙烯一次性超薄袋,方便日常生活
C.75%的乙醇溶液常用来消毒,是因为酒精能够使细菌蛋白质发生变性
D.页岩气是从页岩层中开采出来的天然气。由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
利用100mL0.50mol?L﹣1 Na2CO3溶液配制Na+浓度为0.20mol?L﹣1的溶液,下列操作正确的是
A.将该Na2CO3溶液转移至250mL容量瓶中,加蒸馏水稀释至刻度线,摇匀
B.将该Na2CO3溶液转移至250mL烧杯中,用量筒量取150mL蒸馏水加入,搅拌
C.将该Na2CO3溶液转移至500mL烧杯中,用量筒量取400mL蒸馏水加入,搅拌
D.将该Na2CO3溶液转移至500mL容量瓶中,加蒸馏水稀释至刻度线,摇匀
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
分类方法在化学教材必修I中出现,下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学反应分为放热反应和吸热反应.
A.①② B.②④ C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:填空题
(6分)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
(1)由实验①写出HA的电离方程式是 。
(2)以下各空均选填“>、<、=”。
实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-1
室温下,将pH=3的HA溶液稀释到原体积的10倍后,溶液的pH 4
室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则a b
(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三第三次月考化学试卷(解析版) 题型:选择题
短周期元素X、Y的原子序数相差2,下列叙述正确的是
A.X与Y不可能位于同一周期
B.X与Y不可能形成原子个数比为1∶1型离子化合物
C.X离子与Y离子电子层结构可以相同,也可以不同
D.X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com