
| A. | 有机物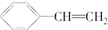 属于芳香烃,含有两种官能团 属于芳香烃,含有两种官能团 | |
| B. | 按系统命名法,化合物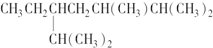 的名称为2,3,6三甲基5乙基庚烷 的名称为2,3,6三甲基5乙基庚烷 | |
| C. | 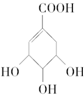 既属于醇类又属于羧酸 既属于醇类又属于羧酸 | |
| D. | 2甲基3丁烯的命名错误原因是选错了主链 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 加NH4Cl溶液 | B. | 加浓氨水 | C. | 加水稀释 | D. | 加NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
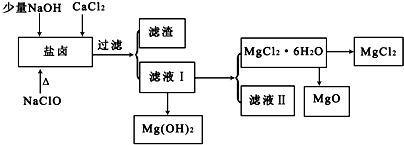
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NH4++H2O═NH3•H2O+H+ | D. | BaSO4(s)?Ba2+(aq)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

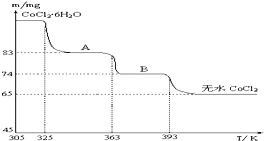
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L CO2中含有原子数为0.3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| C. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| D. | 1L0.1molL-1的氨水中有NA个NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
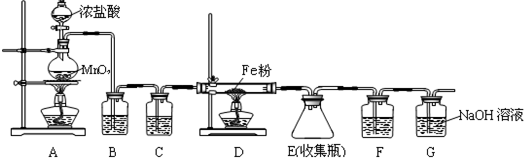
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com