
下列离子方程式书写正确的是( )
A. 苯酚钠溶液中通入少量二氧化碳气体: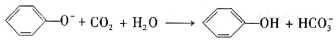
B. 金属铝溶于NaOH溶液:Al + 2OH- =AlO2- + H2↑
C. 澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-=CaCO3↓+ H2O
D. NaHCO3的水解:HCO3- + H2O H3O+ + CO32-
H3O+ + CO32-
科目:高中化学 来源:2016届山西怀仁第一中学高三上学期期中考试化学试卷(解析版) 题型:填空题
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造。
(1)粉红色、不溶于水的Co(OH)2具有两性,其溶于盐酸的离子方程式为_ ,Co(OH)2在空气中慢慢被氧化为棕褐色的Co(OH)3,反应的化学方程式为______________________。
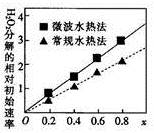
(2)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为_ 。
②两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。由图中信息可知:_ 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果较好的是_ 。
(3) CoCl2常用作多彩水泥的添加剂,可用钴的氧化物(其中Co的化合价为+2、+3)制备,用480 mL 5 mol·L-1盐酸恰好将其完全溶解,得到CoCl2溶液和6.72 L(标准状况下)黄绿色气体。则该钴的氧化物的化学式为_ 。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁沈阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
一般情况下,前者无法决定后者的是( )
A.原子核外电子排布——元素在周期表中的位置
B.化合物熔融状态是否导电——化合物是否为离子化合物
C.分子间作用力的大小——分子稳定性的强弱
D.物质内部储存的能量高低——化学反应的热效应
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次月考理综化学试卷(解析版) 题型:填空题
条件的探索一直是化学工业的重要课题,现有如下两种合成氨的途径:
I. N2(g)+3H2(g) 2NH3(g)△H=-90.0kJ/mol
2NH3(g)△H=-90.0kJ/mol
II. 2N2(g)+6H2O(l) 4NH3(g)+3O2(g)△H=+1530.0kJ/mol
4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式 。
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如图(图中所示数据均为初始物理量)
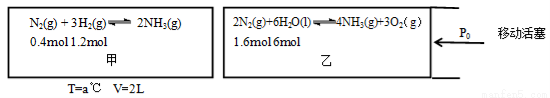
反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解)
①该条件下甲容器中的K= ;平衡时,甲的压强P平= (用P0表示);
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= ;
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
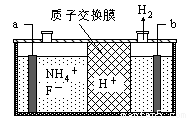
a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知 N2O4(g) 2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
①25℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
②0℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
a.加深 b.变浅 c. 不变 d.无法判断
(5)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s) Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的pH= (已知lg2=0.3)
Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的pH= (已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质;
④根据分散系是否具有丁达尔现象将分散系分为 溶液、胶体和浊液;
溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥根据元素原子最外层电子数的多少将元素分为金属和非金属。
A.只有②⑥ B.只有②⑤ C.只有②③⑤ D.只有②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
①任何化学反应都有反应热 ②化合物MgO、SiO2、Al2O3中化学键的类型相同 ③有些化学键断裂时吸收能量,有些化学键断裂时放出能量 ④PH3分子稳定性和沸点均低于NH3分子 ⑤O3和NO2都是共价化合物 ⑥有热量变化的过程一定有化学键的断裂与形成 ⑦单质中不可能有离子键 ⑧有化学键断裂的变化属于化学变化
A.①④⑦ B.②③ C.③⑤ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高一上期中考试化学试卷(解析版) 题型:选择题
在酸性溶液中能大量共存,且溶液为无色透明的是
A.K+、Na+、MnO4-、SO42- B.NH4+、K+、NO3-、SO42-
C.Na+、K+、Cl-、CO32- D.Fe3+、Cu2+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com