
·ÖĪö £Ø1£©Na3AsO4ČÜŅŗÓėZn·“Ӧɜ³ÉAsH3£¬AsŌŖĖŲ»ÆŗĻ¼Ū×īøß¼Ū+5¼Ū±ä»ÆĪŖ-3¼Ū£¬»ÆŗĻ¼Ū½µµĶ×öŃõ»Æ¼Į£¬Šæ×ö»¹Ō¼Į£»
£Ø2£©øł¾Ż·“Ó¦ĪļŗĶÉś³ÉĪļĄ“·ÖĪö·“Ó¦£¬ŌņĄūÓĆŃõ»Æ»¹Ō·“Ó¦·“Ó¦ÖŠµĆŹ§µē×ÓŹŲŗ楓·ÖĪöĶźČ«·“Ó¦µÄ»¹Ō¼ĮÓė»¹Ō²śĪļĪļÖŹµÄĮæÖ®±ČĄ“½ā“š£¬»¹Ō²śĪļŹĒŌŖĖŲ»ÆŗĻ¼Ū½µµĶ×öŃõ»Æ¼Į±»»¹ŌÉś³É£»
£Ø3£©As2S3Óė×ćĮæÅØĻõĖį·¢Éś·“Ó¦£¬µ±Éś³É48g S£¬ĪļÖŹµÄĮæ=$\frac{48g}{32g/mol}$=1.5mol£¬·“Ó¦µÄAs2S3µÄĪļÖŹµÄĮæĪŖ0.5mol£¬Éś³É±ź×¼×“æöĻĀNO2µÄĢå»żĪŖ112L£¬ĪļÖŹµÄĮæĪŖ$\frac{112L}{22.4L/mol}$=5mol£¬SŌŖĖŲ»ÆŗĻ¼ŪÓÉ-2¼ŪÉżøßµ½0¼Ū£¬0.5molAs2S3·“Ó¦µē×Ó×ŖŅĘ0.5mol”Į[0-£Ø-2£©]”Į3=3mol£¬HNO3×öŃõ»Æ¼Į£¬Éś³É¶žŃõ»ÆµŖ5mol£¬µē×Ó×ŖŅĘĪŖ5mol”Į£Ø5-4£©=5mol£¬Ōņøł¾Żµē×ÓŹŲŗć£¬ÉčAsŹ§µē×ÓŌŖĖŲ»ÆŗĻ¼Ū±ä»ÆĪŖx£¬3+0.5mol”Į2£Øx-3£©=5mol£¬x=5£¬Éś³É²śĪļĪŖH3AsO4£¬1molAs2S3+
ŗĶ10molHNO3·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬½įŗĻŌ×ÓŹŲŗćÅäĘ½ŹéŠ“»Æѧ·½³ĢŹ½£»
£Ø4£©ŠŪ»ĘŌŚæÕĘųÖŠ¼ÓČČÖĮ300”ꏱ»į Į½ÖÖŃõ»ÆĪļ£¬ĘäÖŠÖ®Ņ»Ņ»ÖÖŃõ»ÆĪļĪŖ¾ē¶¾µÄÅųĖŖ£ØAs2O3£©£¬ŅĄ¾ŻŌ×ÓŹŲŗćæÉÖŖĮķŅ»ÖÖŃõ»ÆĪļĪŖ¶žŃõ»ÆĮņ£¬¹żŃõ»ÆĒāÖŠĒāŌŖĖŲ»ÆŗĻ¼Ū-1¼Ū±ä»ÆĪŖ-2¼Ū£¬AsŌŖĖŲ»ÆŗĻ¼Ū+3¼Ū±ä»ÆĪŖ+5¼Ū£¬½įŗĻµē×ÓŹŲŗćŗĶŌ×ÓŹŲŗ抓³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£®
½ā“š ½ā£ŗ£Ø1£©Na3AsO4ČÜŅŗÓėZn·“Ӧɜ³ÉAsH3£¬AsŌŖĖŲ»ÆŗĻ¼Ū×īøß¼Ū+5¼Ū±ä»ÆĪŖ-3¼Ū£¬»ÆŗĻ¼Ū½µµĶNa3AsO4×öŃõ»Æ¼Į£¬Šæ×ö»¹Ō¼Į£»
¹Ź“š°øĪŖ£ŗa£»
£Ø2£©As2S3ŗĶSnCl2ŌŚŃĪĖįÖŠ·“Ó¦×Ŗ»ÆĪŖAs4S4ŗĶSnCl4²¢·Å³öH2SĘųĢ壬Ōņ·“Ó¦ĪŖ2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S£¬
øł¾Żµē×ӵƏ§ŹŲŗćÖŖ2molAs2S3×÷Ńõ»Æ¼Į±»»¹ŌµĆµ½4molµē×Ó£¬Éś³É1molAs4S4£¬¶ų2molSnCl2×÷»¹Ō¼ĮŹ§Č„4molµē×ӵƵ½Ńõ»Æ²śĪļ2molSnCl4£¬Ōņ»¹Ō¼ĮÓė»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1£¬
¹Ź“š°øĪŖ£ŗ2£ŗ1£»
£Ø3£©As2S3Óė×ćĮæÅØĻõĖį·¢Éś·“Ó¦£¬µ±Éś³É48g S£¬ĪļÖŹµÄĮæ=$\frac{48g}{32g/mol}$=1.5mol£¬·“Ó¦µÄAs2S3µÄĪļÖŹµÄĮæĪŖ0.5mol£¬Éś³É±ź×¼×“æöĻĀNO2µÄĢå»żĪŖ112L£¬ĪļÖŹµÄĮæĪŖ$\frac{112L}{22.4L/mol}$=5mol£¬SŌŖĖŲ»ÆŗĻ¼ŪÓÉ-2¼ŪÉżøßµ½0¼Ū£¬0.5molAs2S3·“Ó¦µē×Ó×ŖŅĘ0.5mol”Į[0-£Ø-2£©]”Į3=3mol£¬HNO3×öŃõ»Æ¼Į£¬Éś³É¶žŃõ»ÆµŖ5mol£¬µē×Ó×ŖŅĘĪŖ5mol”Į£Ø5-4£©=5mol£¬Ōņøł¾Żµē×ÓŹŲŗć£¬ÉčAsŹ§µē×ÓŌŖĖŲ»ÆŗĻ¼Ū±ä»ÆĪŖx£¬3+0.5mol”Į2£Øx-3£©=5mol£¬x=5£¬Éś³É²śĪļĪŖH3AsO4£¬1molAs2S3ŗĶ10molHNO3·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗAs2S3+10HNO3=2H3AsO4+3S+10NO2”ü+2H2O£¬AsŌŖĖŲ»ÆŗĻ¼ŪÓÉ+3¼ŪÉżøßµ½+5¼Ū£¬SŌŖĖŲ»ÆŗĻ¼ŪÓÉ-2¼ŪÉżøßµ½0¼Ū£¬ŌņÉś³É2mol H3AsO4£¬×ŖŅʵē×ÓĪŖ2”Į2mol+3”Į2mol=10mol£¬
¹Ź“š°øĪŖ£ŗ+5£¬As2S3+10HNO3=2H3AsO4+3S+10NO2”ü+2H2O£»
£Ø4£©ŠŪ»ĘŌŚæÕĘųÖŠ¼ÓČČÖĮ300”ꏱ»į Į½ÖÖŃõ»ÆĪļ£¬ĘäÖŠÖ®Ņ»Ņ»ÖÖŃõ»ÆĪļĪŖ¾ē¶¾µÄÅųĖŖ£ØAs2O3£©£¬ŅĄ¾ŻŌ×ÓŹŲŗćæÉÖŖ·“Ó¦ĪŖ£ŗAs4S4+7O2$\frac{\underline{\;300”ę\;}}{\;}$2As2O3+4SO2£¬ĮķŅ»ÖÖŃõ»ÆĪļĪŖ¶žŃõ»ÆĮņ£¬Ė«ŃõĖ®½«As2O3Ńõ»ÆĪŖH3AsO4¶ų³żČ„£¬Ńõ»Æ»¹Ō·“Ó¦ÖŠ¹żŃõ»ÆĒāÖŠĒāŌŖĖŲ»ÆŗĻ¼Ū-1¼Ū±ä»ÆĪŖ-2¼Ū£¬AsŌŖĖŲ»ÆŗĻ¼Ū+3¼Ū±ä»ÆĪŖ+5¼Ū£¬½įŗĻµē×ÓŹŲŗćŗĶŌ×ÓŹŲŗ抓³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ2H2O2+H2O+As2O3=2H3AsO4£¬
¹Ź“š°øĪŖ£ŗSO2£¬2H2O2+H2O+As2O3=2H3AsO4£®
µćĘĄ ±¾Ģāæ¼²éĮĖŠÅĻ¢·ÖĪö£¬ĪļÖŹŠŌÖŹµÄÓ¦ÓĆ£¬Ö÷ŅŖŹĒŃõ»Æ»¹Ō·“Ó¦µē×Ó×ŖŅĘ”¢µē×ÓŹŲŗć”¢»Æѧ·½³ĢŹ½ŹéŠ“”¢“ķĪóÅŠ¶Ļ£¬×¢ŅāŃõ»Æ»¹Ō·“Ó¦øÅÄīŗĶµē×Ó×ŖŅĘŹŲŗćµÄÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£®


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
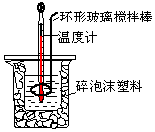 ÓĆ50mL0.50mol/LŃĪĖįÓė50mL 0.55mol/L NaOHČÜŅŗ£¬ŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®²ā¶ØĒæĖįÓėĒæ¼ī·“Ó¦µÄ·“Ó¦ČČ£®
ÓĆ50mL0.50mol/LŃĪĖįÓė50mL 0.55mol/L NaOHČÜŅŗ£¬ŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®²ā¶ØĒæĖįÓėĒæ¼ī·“Ó¦µÄ·“Ó¦ČČ£®| ĘšŹ¼ĪĀ¶Čt1/”ę | ÖÕÖ¹ĪĀ¶Č t2/”ę | ĪĀ¶Č²ī £Øt2-t1£©/”ę | |||
| HCl | NaOH | Ę½¾łÖµ | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ņõ¼« | B£® | Ńō¼« | C£® | Õż¼« | D£® | øŗ¼« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | W | X | Y | Z | 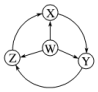 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k£®Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2£ØSO4£©3 |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
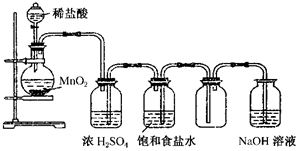 ČēĶ¼ĖłŹ¾ŹĒÄ³Ń§ÉśÉč¼ĘµÄŹµŃéŹŅÖʱøøÉŌļCl2¼°ĪüŹÕ¶ąÓąCl2µÄŹµŃé×°ÖĆĶ¼£¬øł¾ŻĶ¼ÖŠµÄ×°ÖĆŗĶÓŠ¹ŲŹŌ¼Į»Ų“šĻĀĮŠĪŹĢā£®
ČēĶ¼ĖłŹ¾ŹĒÄ³Ń§ÉśÉč¼ĘµÄŹµŃéŹŅÖʱøøÉŌļCl2¼°ĪüŹÕ¶ąÓąCl2µÄŹµŃé×°ÖĆĶ¼£¬øł¾ŻĶ¼ÖŠµÄ×°ÖĆŗĶÓŠ¹ŲŹŌ¼Į»Ų“šĻĀĮŠĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
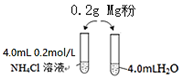 ijŠ£»ÆѧæĪĶāѧĻ°Š”×é·¢ĻÖ½«Ć¾·Ū°“Ķ¼Ķ¶Čė“æĖ®ÖŠĻÖĻó²»Ć÷ĻŌ£¬¶ųĶ¶ČėĀČ»Æļ§ČÜŅŗÖŠ£¬Į½ÕßĮ¢¼“·¢Éś·“Ó¦£¬²śÉś“óĮæĘųÅŻ£®¾¼ģŃéøĆ¹ż³Ģ²śÉśĮ½ÖÖĘųĢ壬ĘäÖŠŅ»ÖÖĘųĢåÓŠ“Ģ¼¤ŠŌĘųĪ¶£®
ijŠ£»ÆѧæĪĶāѧĻ°Š”×é·¢ĻÖ½«Ć¾·Ū°“Ķ¼Ķ¶Čė“æĖ®ÖŠĻÖĻó²»Ć÷ĻŌ£¬¶ųĶ¶ČėĀČ»Æļ§ČÜŅŗÖŠ£¬Į½ÕßĮ¢¼“·¢Éś·“Ó¦£¬²śÉś“óĮæĘųÅŻ£®¾¼ģŃéøĆ¹ż³Ģ²śÉśĮ½ÖÖĘųĢ壬ĘäÖŠŅ»ÖÖĘųĢåÓŠ“Ģ¼¤ŠŌĘųĪ¶£®| ŠņŗÅ | ŹµŃéŹŌ¼Į | ŹµŃéĻÖĻó | |
| ŹµŃé1-1 | 0.20gĆ¾·Ū | 3.0mL 0.2mol/LNH4ClČÜŅŗ | ·“Ó¦Ć÷ĻŌ£¬ÓŠĘųÅŻ²śÉś |
| ŹµŃé1-2 | 0.20gĆ¾·Ū | 3.0mLŃĪĖį | ·“Ó¦²»Ć÷ĻŌ£¬¼øŗõƻӊĘųÅŻ²śÉś |
| ŹµŃéŠņŗÅ | ŹµŃéŹŌ¼Į | |
| ŹµŃé2-1 | 0.20gĆ¾·Ū | 3.0 mL 0.2mol/LNaClČÜŅŗ |
| ŹµŃé2-2 | 0.20gĆ¾·Ū | 3.0 mL0.2mol/LNaNO3ČÜŅŗ |
| ŹµŃé3-1 | 0.20gĆ¾·Ū | 3.0mL0.2mol/L NH4NO3ČÜŅŗ |
| ŹµŃé3-2 | 0.20gĆ¾·Ū | 3.0mL0.2mol/L KNO3ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com