
| A. | 已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为:H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 向NH4A1(SO4)2溶液中滴人Ba(OH)2溶液恰好使SO42-沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 已知中和热为57.3 kJ•mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH (aq)═Na2SO4 (aq)+2H2O ( l )△H=-114.6 kJ•mol-1 | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
分析 A.燃烧热必须生成稳定的氧化物,水在液态更稳定;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2;
C.依据中和热的定义可知:稀的强酸与强碱发生中和反应生成1mol水放出的热量,而稀硫酸与氢氧化钠稀溶液反应生成2mol水,则放出热量为114.6KJ;
D.得失电子不守恒;
解答 解:A.已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为:H2(g)+1/2O2(g)═H2O(l)△H=-285.8 kJ•mol-1,故A错误;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故B错误;
C.已知中和热为57.3 kJ•mol-1,稀硫酸与氢氧化钠稀溶液反应生成2mol水,放出热量为114.6KJ,热化学方程式:H2SO4 (aq)+2NaOH (aq)═Na2SO4 (aq)+2H2O ( l )△H=-114.6 kJ•mol-1,故C正确;
D.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4的离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,故D错误;
故选:C.
点评 本题考查了离子方程式、热化学方程式的书写,明确离子反应实质、燃烧热的概念是解题关键,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H6的结构简式:CH3CH3 | B. | O2-的结构示意图: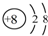 | ||
| C. | CO2的结构式:O=C=O | D. | HClO的电子式:H:Cl:O: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①、② | C. | ①、②、③ | D. | ①、②、③、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片放入氢氧化钠溶液中:2Al+2H2O+2OH-═2AlO2-+3H2↑ | |
| B. | 钠与水反应:Na+2H2O═Na++OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgNO3溶液中滴加盐酸:Ag++Cl-=AgCl↓ | |
| B. | 向Ba(OH)2溶液中加硫酸溶液:Ba2++SO42-=BaSO4↓ | |
| C. | 利用醋酸(CH3COOH)溶解含碳酸钙的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 盐酸溶液中滴加NaHCO3溶液:2H++CO32-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 金属单质在反应中只能作还原剂,非金属单质在反应中只能作氧化剂 | |
| C. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| D. | 氧化剂具有氧化性,还原剂具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
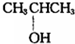 ⑨$\stackrel{13}{6}$C ⑩CH3OH.
⑨$\stackrel{13}{6}$C ⑩CH3OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com