
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。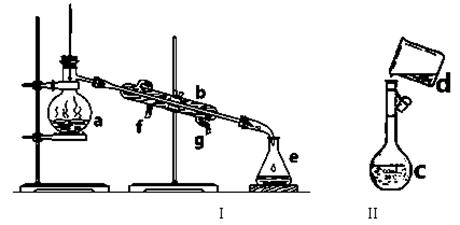
⑴写出下列仪器的名称:a. b. c.
⑵仪器a~c中,使用前必须检查是否漏水的有 。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,
将仪器补充完后进行实验,温度计水银球的位置在 处。
冷凝水由 (填f或g)口通入。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有: 。
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
(1)蒸馏烧瓶 冷凝管 容量瓶 (2)c (3)酒精灯 蒸馏烧瓶支管口 g
(4)①未用玻璃棒引流 玻璃棒、胶头滴管 (每个1分) ②BCAFED
解析试题分析:图示的各个仪器的名称分别是A蒸馏烧瓶 B冷凝管 C容量瓶D烧杯E锥形瓶。利用蒸馏装置对沸点不同的互溶的液体混合物进行分离,需要加热,所以需要酒精灯,温度计水银球的位置在蒸馏烧瓶支管口附近。冷凝水由下口g加入。在配制物质的量浓度NaOH溶液时需要用到的仪器还应该有玻璃棒、胶头滴管,并且在移液时要用玻璃棒引流,以防液体外流洒出。配制时,其正确的操作顺序是BCAFED。
考点:考查常用仪器的识别、使用,蒸馏等混合物的分离方法及物质的量浓度的溶液的配制过程及注意事项等知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤4中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
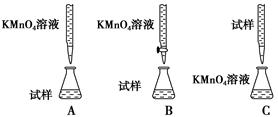
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
| A.稀硫酸 | B.浓硝酸 | C.稀硝酸 | D.稀盐酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0mL于锥形瓶,加入10.0 mL KI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1 的Na2S2O3标准液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6 (Na2S4O6溶液为无色)。试回答下列问题:
(1)步骤①加入的指示剂是 。
(2)步骤①反应的离子方程式是 。
(3)步聚③当待测液由 色变为 色且30s不再变化即达终点,若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为 。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度 (填“偏大”、“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度 (填“偏大”、“偏小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ 表Ⅱ
| 编号 | V (Na2CO3)/mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a 。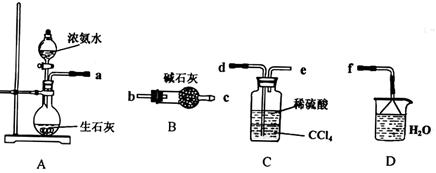
(2)将装置C中两种液体分离开的操作名称是_________。装置D的作用是 。
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①判断此滴定实验达到终点的方法是: 。
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“不受影响”、“偏低”或“偏高”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3)可由下面一系列反应制得:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3 + S  Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;
Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。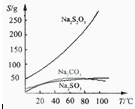
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
请问:仪器2的名称为 ,
装置6中可放入 。
| A.BaCl2溶液 | B.浓H2SO4 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |

 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学进行试验探究时,欲配制1.0molL-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
为探究原因,该同学查得Ba(OH)2·8H2O 部分溶解度数据,见下表:
| 温度 | 283K | 293K | 303K |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | ###### |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | _______________________ |
| 步骤3:取适量步骤1中的沉淀于试管中, ,连接带塞导气管将产生的气体导入澄清石灰水中。 | _______________________ ______________________ |
| 步骤4:取步骤1中的滤液于烧杯中,______________________________ | _______________________,说明该试剂中含有Ba(OH)2。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤; ②加过量NaOH溶液; ③加过量盐酸; ④加过量Na2CO3溶液; ⑤加过量BaCl2溶液。其中正确的操作顺序
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com