
分析 (1)氯化氢能够与饱和碳酸氢钠溶液反应生成氯化钠、二氧化碳和水;氢氧化钠溶液能够与二氧化碳反应生成碳酸钠和水;碳酸钠溶液与二氧化碳反应生成碳酸氢钠;
(2)碳酸钠溶液与二氧化碳反应生成碳酸氢钠,碳酸钠溶解度大于碳酸氢钠.
解答 解:(1)氯化氢能够与饱和碳酸氢钠溶液反应生成氯化钠、二氧化碳和水,反应的离子方程式:H++HCO3-=H2O+CO2↑,所以可以用饱和碳酸氢钠除去二氧化碳中的氯化氢;氢氧化钠溶液能够与二氧化碳反应生成碳酸钠和水,离子方程式:CO2+2OH-=H2O+CO32-;碳酸钠溶液与二氧化碳反应生成碳酸氢钠,离子方程式:
CO2+CO32-+H2O=2HCO3-;
故答案为:饱和NaHCO3溶液;H++HCO3-=H2O+CO2↑;CO2+2OH-=H2O+CO32-;CO2+CO32-+H2O=2HCO3-;
(2)向饱和Na2CO3溶液中通入足量CO2,发生反应Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶解度大于NaHCO3,则NaHCO3溶液为过饱和溶液,所以生成NaHCO3沉淀导致溶液变浑浊,离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓;
故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓.
点评 本题考查了物质的提纯,明确除杂原则:不能引入新杂质是解题关键,题目难度不大,注意碳酸钠与碳酸氢钠的性质.


科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 1mol•L-1的溶液中,pH(HCN)>pH(H2CO3)>pH(CH3COOH) | |
| B. | 升高温度,HCN溶液中HCN的电离平衡正向移动,电离平衡常数增大 | |
| C. | 0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比小于2:1 | |
| D. | 饱和H2CO3溶液中c(H+)与c(CO32-)的比值小于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
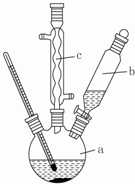 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: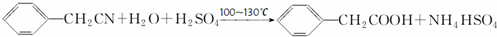 ;
;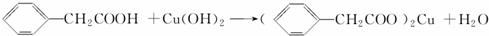
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
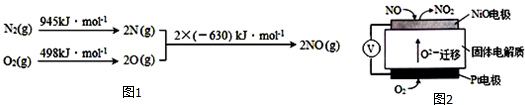
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
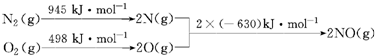
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物平衡浓度较大 | B. | 反应越有利于往逆反应方向进行 | ||
| C. | 反应进行的越彻底 | D. | 生成物平衡浓度较小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com