
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
依据下列条件能将某溶液的物质的量浓度计算出来的是( )
①每10 mL溶液中含有0.23 g Na+的硫酸钠溶液
②每10个水分子中溶有1个Na+的NaOH溶液
③浓度为18.4 mol·L-1的硫酸10 mL加到100 mL水中所得的稀硫酸
④标准状况下,100 mL氨气溶于20 mL水中所得溶液的密度为0.9 g·cm-3的氨水
A.①② B.①③
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+ O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
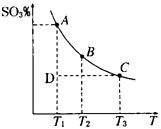
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
②若温度为T1时,反应进行到状态D时,V正_______V逆(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产中有重要作用。
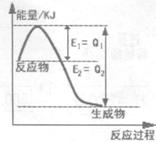
① 右图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:(△H用含字母Q1、Q2的代数式表示) 。
②在AlCl3溶液中滴加氨水,反应的离子方程式为: 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是 全品教学网, 用后离不了!,产生该现象的原因是(用离子方程式表示): 。
全品教学网, 用后离不了!(已知25℃时Ksp[AgCl] =1.0×10-10 mol2•L-2,Ksp[AgI] =1.5×10-16mol2•L-2 )
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是CO2电催化还原为CH4的工作原理示意图。下列说
法不正确的是
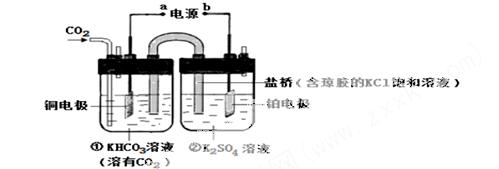
A.该过程是电能转化为化学能的过程
B.一段时间后,①池中n(KHCO3)不变
C.一段时间后,②池中溶液的pH 一定下降
D.铜电极的电极反应式为CO2+8H++8e- = CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.1 mol KClO3参加反应有2 mol电子转移
D.H2C2O4在反应中被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是

A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaH SO3反应速率为5.0 ×10-5mol·L-1·s-1
SO3反应速率为5.0 ×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该试验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在溶液中可以发生反应:X+2Y3+===X2++2Y2+,则下列解释:①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+要强.其中正确的是( )
A.②④⑥ B.①③④
C.①③⑤⑥ D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)判断下列物质在相应条件下能否电离。
①液态HCl:___________。
②熔融状态下的NaNO3___________。
③固体KOH: ___________。
(2)写出下列物质在水溶液中的电离方程式:
K2SO4: _______________________________________________________;
NH4NO3: ______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com