
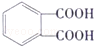
 分子中,处于同一平面上的碳原子数最多可能有( )
分子中,处于同一平面上的碳原子数最多可能有( )| A. | 6个 | B. | 8个 | C. | 10个 | D. | 12个 |
科目:高中化学 来源: 题型:解答题
 SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:
SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )| A. | n(CH4)/n(N2)越小,CH4的转化率越高 | |
| B. | n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 | |
| C. | b点对应的平衡常数与a点一样 | |
| D. | a点对应的NH3的体积分数约为26% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.25 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v (C)=0.3 mol/(L•min) | D. | v(D)=0.1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 苯酚能与氢氧化钠反应而乙醇不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.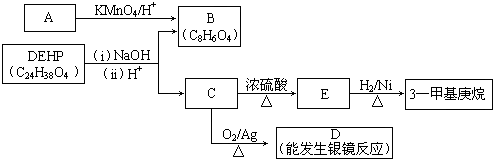
 .
. .
.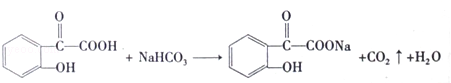 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液中:Na+,H+,NO3- | B. | 碘化钾溶液中:H+,H2O,SO32- | ||
| C. | 偏铝酸钠溶液中:K+,Cl-,SO42- | D. | 氢氧化钙溶液中:Na+,ClO-,HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com