
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究:
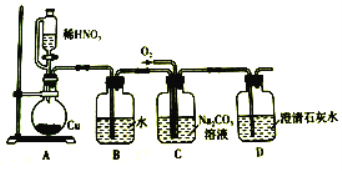
Ⅰ.亚硝酸钠的制备。
(1)装置B的作用是________________________。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为______________。
Ⅱ.探究亚硝酸钠与硫酸反应![]() 气体产物成分。
气体产物成分。
已知:①NO+NO2+2OH-=2NO+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃

(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是_______________________。
(4)仪器的连接顺序(按左→右连接):A→C→________。
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,装置A中产生红棕色气体。若D中通入过量O2,装置B中的化学方程式是_______________________。
Ⅲ.设计实验证明酸性条件下NaNO2具有氧化性。
(6)供选用的试剂:NaNO2溶液、KMnO4溶液、Fe2(SO4)3溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液___________________________________________________。
【答案】除去HNO3 4NO+O2+2CO32-=4NO2-+2CO2 排尽空气,防止可能生成的NO被完全氧化成NO2,造成对A中反应产物检验的干扰 E→D→B 4NO2+O2+4NaOH=4NaNO3+2H2O 取碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性
【解析】
(1)硝酸易挥发,所以装置B的作用是除去HNO3;
(2)N元素化合价升高,必有O2参与,同时澄清石灰水变浑浊,有CO2生成,反应方程式为:4NO+O2+2CO32-=4NO2-+2CO2;
(3)空气中的氧气能氧化NO,所以必须先排尽空气,防止可能生成的NO被完全氧化成NO2,造成对A中反应产物检验的干扰;
(4)由于NO2的液化温度高,所以首先检验NO2,即先通过E,然后再通过D,最后需要有尾气处理;
(5)若氧气过量,则进入B装置的气体全部是NO2,所以反应的方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O;
(6)取碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性。
Ⅰ.(1)硝酸易挥发,所以装置B的作用是除去HNO3,故答案为:除去HNO3。
(2)N元素化合价升高,必有O2参与,同时澄清石灰水变浑浊,有CO2生成,则C中制备NaNO2的离子方程式为:4NO+O2+2CO32-=4NO2-+2CO2,故答案为:4NO+O2+2CO32-=4NO2-+2CO2。
Ⅱ.(3)空气中的氧气能氧化NO,所以必须先排尽空气,防止可能生成的NO被完全氧化成NO2,造成对A中反应产物检验的干扰,故答案为:排尽空气,防止可能生成的NO被完全氧化成NO2,造成对A中反应产物检验的干扰。
(4)由于NO2的液化温度高,所以首先检验NO2,即先通过E,然后再通过D,最后需要有尾气处理,即连接顺序是E→D→B,故答案为:E→D→B。
(5)若氧气过量,则进入B装置的气体全部是NO2,所以反应的方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O,故答案为:4NO2+O2+4NaOH=4NaNO3+2H2O。
Ⅲ.(6)取碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性,故答案为:取碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性。


科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A.常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:![]()
B.能使酚酞变红的溶液中:![]()
C.0. 1 mol·L1KI 溶液:![]()
D.常温下, 的溶液中:
的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将VL含CuSO4和Na2SO4的混合溶液分成两等份,一份加入含xmolKOH的溶液,恰好使Cu2+完全转化为Cu(OH)2沉淀;另一份加入含ymolBaCl2的溶液,恰好使SO42完全转化为BaSO4沉淀。则原混合溶液中Na+的浓度为( )
A.![]() mol·L1B.
mol·L1B.![]() mol·L1
mol·L1
C.![]() mol·L1D.
mol·L1D.![]() mol·L1
mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C—C单键可以绕键轴旋转,其结构简式如下可表示为的烃,下列说法中正确的是
![]()
A. 该烃是苯的同系物B. 分子中最多有6个碳原子处于同一直线上
C. 该烃的一氯代物最多有四种D. 分子中至少有10个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示。有关粒子浓度大小关系的比较正确的是( )

A.在A、B间任一点(不包含A、B两点),溶液中一定有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.在B点,a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B.Fe溶于足量稀HNO3:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
C.AlCl3溶液中滴入过量稀氨水:Al3++4NH3H2O=AlO2-+4NH4++2H2O
D.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32gNa2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况) 关系如图所示,下列说法中错误的是( )
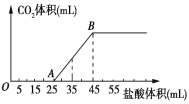
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B.A点溶液中的溶质为NaCl、NaHCO3
C.混合物中NaOH的质量0.60g
D.当加入35mL盐酸时,产生CO2的体积为224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
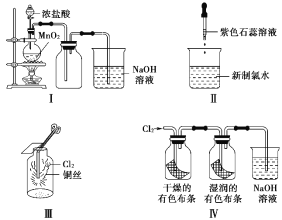
A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水具有酸性和漂白性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:有色布条均褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)3.6gH2O物质的量为________mol,约含有_______个原子;
(2)已知1.204×1023个X气体的质量是6.4g。则X气体的摩尔质量是________;
(3)制备Fe(OH)3胶体的化学方程式:________;
(4)实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为(MnCl2是可溶性盐)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,该反应中氧化剂是_______,氧化产物是________(填化学式),写出上述化学方程式对应的离子方程式__________。
MnCl2+Cl2↑+2H2O,该反应中氧化剂是_______,氧化产物是________(填化学式),写出上述化学方程式对应的离子方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com