
在无色透明的溶液中可以大量共存的离子组是( )
A.Mg2+、K+、Cl-、NO3- B. H+、K+、HCO3-、NO3-
C.Cu2+、NO3-、SO42-、Cl- D. OH-、Cl-、Na+、Al3+
科目:高中化学 来源: 题型:
下面各装置图能达到实验目的的是
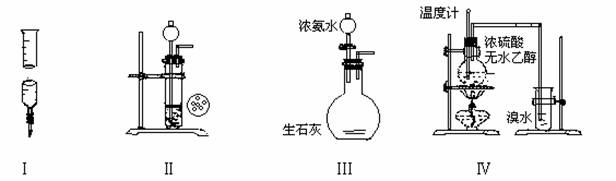
A.实验Ⅰ量取20.0mL的H2SO4待测液放入锥形瓶中
B.实验Ⅱ用CaC2和饱和食盐水反应制取C2H2
C.实验Ⅲ制取氨气
D.实验Ⅳ溴水褪色证明了乙烯可以与溴发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学──选修2:化学与技术] (15分)
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
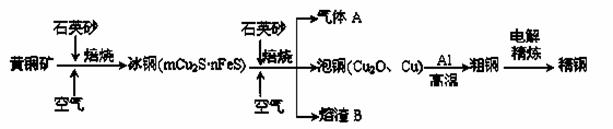
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2) ①冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、______________________________;
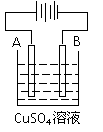 ②熔渣B的主要成分是_______________。
②熔渣B的主要成分是_______________。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)粗铜(含Fe、Ag、Pt、Au等杂质) 的电解精炼如图所示,A极上
发生的反应为__________________________________________,
下列说法正确的是 。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.阴阳两极质量变化相等
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,
其正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应
① 2NaI + MnO2 + 3H2SO4 = 2NaHSO4 + MnSO4 + 2H2O + I2
② 2NaIO3 + 5NaHSO3 = 2Na2SO4 + 3NaHSO4 + H2O + I2。下列说法正确的是
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2 > SO42- > IO3- > I2
D.反应①、②中生成等量的I2时转移电子数比为1︰5
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:


(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3 + 3S 2Al2O3 + 9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
(2)将标况下1.12L炉气通入100mL 0.5mol/L NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为_______________________________________。
(3)熟料溶解时反应的离子方程式为 。
(4)检验废渣中含有Fe2O3所需的试剂是_________。
(5)母液中溶质主要成分化学式为 ,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是………
A.①②③④ B.③①②④ C.④②①③ D.③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
只用下列试剂中的一种就能将FeCl3、FeCl2、AlCl3和NaCl四种溶液区别开的是( )
A. KSCN溶液 B. BaCl2溶液 C. NaOH溶液 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同。
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属单质、NO2和O2。
2KNO3 2KNO2↑+O2↑ 2Cu(NO3)2
2KNO2↑+O2↑ 2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足
量的稀H2SO4得到相应两份溶液,进行以下探究实验。
【提出猜想】猜想一:Fe元素只显+2价;
猜想二:Fe元素只显+3价;
猜想三:Fe元素____ _____。
【实验操作】①向一份溶液中滴入KSCN溶液②将稀酸性KMnO4溶液中滴入另一份溶液
【实验现象】实验① ;实验② 。
【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)

实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重
新连接好仪器;④加热;⑤……
(1)乙同学使用A装置收集气体,恰好收集到常温常压下27mL的红棕色气体,为确保数据的准确性,读数时必须 。
(2)乙同学用带火星木条检验量筒内气体时,发现木条燃烧,且颜色变浅甚至无色,下列判断中正确的是 。
a.气体中只有NO2 b.气体是O2、NO2的混合物
c.支持燃烧的气体只有O2 d.NO2支持燃烧
(3)丙同学取等质量的Fe(NO3)2使用B装置收集气体,可收集到 mL气体。
【实验三】探究固体混合物的成分。小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是( )
A.1:2:2 B.2:1:3 C.1:2:3 D.3:8:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com