
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
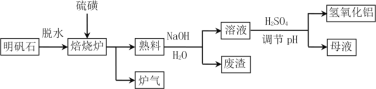
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
【答案】Al2(SO4) 3 3.612×1024 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) Al2O3 +2OH- =2AlO2- + H2O K2SO4 Na2SO4 取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净
【解析】
(1)所含元素化合价降低的反应物是氧化剂;再根据N=nNA转移电子数目;
(2)根据反应后溶液中溶质为NaHSO3,溶液呈碱性,判断溶液中各离子的浓度大小;
(3)熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
(4)母液中离子主要为K+,Na+,SO42-;通过检验硫酸根离子的方法进行试验。
(1)反应中硫元素的化合价由Al2(SO4)3中的+6价降低为SO2的+4价,故Al2(SO4)3为氧化剂,反应中硫单质中硫元素的化合价由0价升高为SO2的+4价,硫单质为还原剂,生成1molAl2O3时需要硫的物质的量为1mol×3/2=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024,故答案为:故Al2(SO4)3,3.612×1024。
(2)1.12L二氧化硫的物质的量为1.12L÷22.4L/mol=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=1:1,故反应后溶液中溶质为NaHSO3,溶液呈碱性,说明HSO3-的电离程度大于水解程度,同时水解生成氢离子,故c(H+)>c(SO32-),HSO3-的电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中各种离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
(3)由工艺流程可以知道,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为:Al2O3 +2OH- =2AlO2- + H2O,故答案为:Al2O3 +2OH- =2AlO2- + H2O。
(4)由工艺流程可以知道,熟料溶解所得到的溶液中含有K+,Na+,SO42-,AlO2-,OH-等,加硫酸调节pH值,AlO2-转化为Al(OH)3,母液中离子主要为K+,Na+,SO42-,含有溶质为K2SO4、Na2SO4;Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行试验,方法为取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,故答案为:K2SO4、Na2SO4;取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净。


科目:高中化学 来源: 题型:
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.20mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
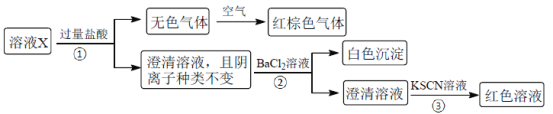
下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.由步骤③可知,原溶液肯定存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列判断正确的是
A. 标准状况下,2.24L苯中含有碳碳双键数为0.3NA
B. 6.4gS2、S4和S8的混合物中所含硫原子数为0.2NA
C. 1L0.1mol·L-1的氢碘酸中含碘化氢分子数为0.1NA
D. 60g乙酸与足量乙醇发生酯化反应时断裂的C-O键数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
Ⅰ、金属Ca的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca+H2![]() CaH2(固体)
CaH2(固体)
Ⅱ、固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑;②CaH2要密封保存。
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).

回答下列问题:
(1)写出Ca常温遇水发生反应的化学方程式: 。
(2)B、D中所盛试剂相同,该试剂为 (填名称);D中该试剂的作用是 。
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: 。
【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2 样品,按图所示连接仪器(固定装置略)。

步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL。
(4)若该实验条件下的气体摩尔体积为Vm L/mol,当V= mL时(用m、Vm表示),表明制得的CaH2样品是纯净的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH =b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)= _。

(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。已知:①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布为msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)下列叙述正确的是________(填序号)。
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大的元素是E
D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为_____;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素为_____(填元素符号)。
(3)E单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
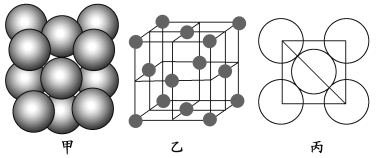
若已知E的原子半径为d,NA代表阿伏加德罗常数,E的相对原子质量为Mr,则一个晶胞中E原子的数目为________,该晶体的密度为_______________ (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,具有十分巨大的开发潜力。工业上从海水提取金属镁的流程如下:
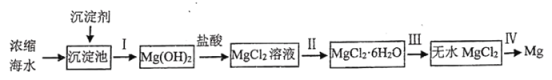
回答下列问题:
(1)沉淀剂是________________(填化学式),不选用同类的其他物质的理由是_______________。
(2)下列选项中,涉及的操作包含操作Ⅰ的是___________。
A 实验室从溴水中提取溴单质
B 除去![]() 固体中的少量NaCl
固体中的少量NaCl
C 从![]() 分解产物中获得
分解产物中获得![]()
D 用工业酒精制无水乙醇
(3)在进行步骤Ⅱ时,如果没有加入盐酸,可能产生的杂质是______________(填化学式)。
(4)一种模拟工业用![]() 制无水
制无水![]() 的实验室设计如下:
的实验室设计如下:
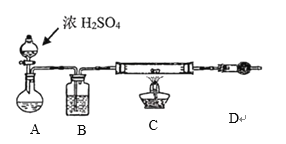
装置A中盛放液体是______________,装置D的作用是____________________________。
(5)步骤Ⅳ发生反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种元素,已知B原子序数大于A,A与B质子数之和为27,质子数之差为5,0.9gC单质与足量盐酸作用 放出标态下1.12 L氢气,同时生成C的三氯化物,回答下列问题:
(1)C的元素符号是________________。
(2)A的原子结构示意图________。
(3)B的氢化物的电子式____________。
(4)排出三种元素最高价氧化物对应的水化物酸碱性由强到弱的顺序_____。
(5)A和C两种元素最高价氧化物对应的水化物反应的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氢氧化钠固体配制溶液的过程:称取10.0 g氢氧化钠固体,在烧杯中加水搅拌溶解后,用如图所示的容量瓶来配制氢氧化钠溶液,回答下列问题:
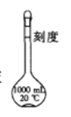
(1)______(填“能”或“不能”)将溶解后的氢氧化钠立即转移到容量瓶中。
(2)所配制的氢氧化钠溶液的物质的量浓度是_______molL-1.
(3)取出所配制的溶液10 mL,加水稀释至500 mL,稀释后溶液溶质的物质的量浓度是_______mol L-1.
(4)将CO2通入氢氧化钠溶液(过量)中,写出发生反应的化学方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com