
| A. | Cu2+、Mg2+、SO42-、NO3- | B. | K+、Mg2+、SO42+、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Ba2+、NO3-、OH- |
科目:高中化学 来源: 题型:解答题
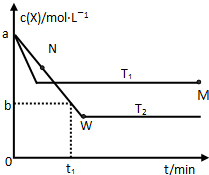 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 在H2S?H++HS-的平衡体系升温到100℃时,溶液中的c(H+)一定增大 | |
| D. | 在盐酸中加入KCl晶体,溶液pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是吸热反应 | |
| B. | 生成物的总能量低于反应物的总能量 | |
| C. | 导致醋酸凝固的原因:该反应吸热使大烧杯中的热能转化为小烧杯中产物的内能 | |
| D. | 该反应的热化学方程式为:NH4HCO3(s)+HCl(aq)=NH4Cl(aq)+CO2(g)+H2O(l)△H=+Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二溴乙烷:Br2-CH2-CH2-Br | B. | 3,3,4-三甲基己烷: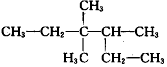 | ||
| C. | 3乙基1丁烯: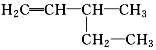 | D. | 2,2,3三甲基戊烷: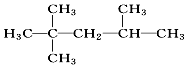 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 药品橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
| 药品 | 醋酸,乙醇 | CuSO4•5H2O,MgCl2 | 白磷,硫黄 | 镁条,锌粒 |
| A. | 甲橱 | B. | 乙橱 | C. | 丙橱 | D. | 丁橱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
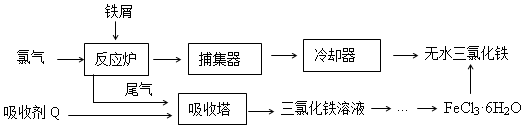
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:实验题
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究——按如图装置(固定装置已略)进行实验:
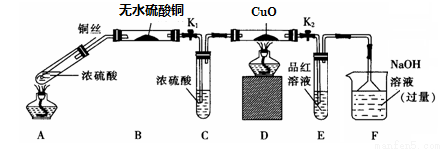
(1)F装置的烧杯中发生反应的离子方程式是 ;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 ;
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 ;
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验II:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4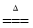 cCu2S+dCuSO4+eH2O。则a∶b= 。
cCu2S+dCuSO4+eH2O。则a∶b= 。
(6)为进一步探究该黑色物质的成分,经查阅相关文献获得下列资料。
资料1:
硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
14 | Cu 片表面无明显现象 | |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的如下结论中正确是 。
A.铜与浓硫酸反应时所涉及的反应可能不止一个
B.硫酸浓度选择适当,可避免最后产物中出现黑色物质
C.该反应发生的条件之一是硫酸浓度 ≥ 15 mol/L
D.硫酸浓度越大,黑色物质越快出现、越难消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com