

分析 (1)第二步反应②为:N2O2(g)+O2(g)?2NO2,根据盖斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),总的热化学方程式-①可得②;
(2)根据=$\frac{△C}{△t}$计算v(NO2),再根据速率之比等于化学计量数之比计算v(O2);平衡时c(NO2)=0.02mol/L,则△c(O2)=$\frac{1}{2}$×(0.04-0.02)mol/L=0.01mol/L,△c(NO)=△c(NO2)=(0.04-0.02)mol/L=0.02mol/L,代入平衡常数K=$\frac{c{\;}^{2}(N{O}_{2})}{c{\;}^{2}(NO)c({O}_{2})}$计算;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)慢反应决定整个过程的反应速率;决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢;
(5)若(2)中反应体系,反应开始时使用催化剂,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时二氧化氮的浓度不变;
(6)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-.
解答 解:(1)第二步反应②为:N2O2(g)+O2(g)?2NO2,根据盖斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),总的热化学方程式-①可得②,则反应②的热化学方程式为:N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1 ;
故答案为:N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1 ;
(2)前10s内v(NO2)=$\frac{(0.040-0.025)mol/L}{10s}$=0.0015mol/(L•S),速率之比等于化学计量数之比,v(O2)=$\frac{1}{2}$v(NO2)=7.5×10-4mol/(L.min);
平衡时c(NO2)=0.02mol/L,则△c(O2)=$\frac{1}{2}$×(0.04-0.02)mol/L=0.01mol/L,△c(NO)=△c(NO2)=(0.04-0.02)mol/L=0.02mol/L,代入平衡常数K=$\frac{c{\;}^{2}(N{O}_{2})}{c{\;}^{2}(NO)c({O}_{2})}$=$\frac{0.02{\;}^{2}}{0.02{\;}^{2}0.01}$=100;
故答案为:7.5×10-4mol/(L.min);100;
(3)a.依据速率之比等于计量系数之比:v正(O2)=$\frac{1}{2}$V正(NO),则v正(O2)≠v逆(O2),故a错误;
b.混合气体的平均相对分子质量不随时间变化而变化的状态,说明气体的总物质的量不变,达平衡状态,故b正确;
c.当体系达平衡状态时,c(NO):c(O2):c(NO2)=2:1:2,也可能不是,与各物质的初始浓度及转化率有关,故c错误;
d.依据ρ=$\frac{m}{V}$,密度一直不随时间的变化,故d错误;
e.反应前后气体系数和不相等,压强随着反应进行不断变化,当压强不变时可以作为判断依据,故d正确;
f.混合气体的颜色保持不变,意味二氧化氮浓度不变,可以作为判断依据,故f错误;
故选:bef;
(4)慢反应决定整个过程的反应速率,决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢,
故答案为:决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢;
(5)若(2)中反应体系,反应开始时使用催化剂,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时二氧化氮的浓度不变,在图中画出该反应体系反应进程可能的曲线为: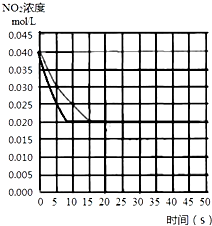 ,
,
故答案为: ;
;
(6)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-,电极反应式为:2NOx+4xe-=N2+2xO2-,若NOx为NO,则电极反应式为:2NO+4e-=N2+2O2-;
故答案为:2NO+4e-=N2+2O2-;
点评 本题为综合题,考查化学平衡计算与影响因素、反应速率计算、盖斯定律应用、电解原理等,难度中等,注意对基础知识理解掌握,答题时注意题中信息的灵活运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
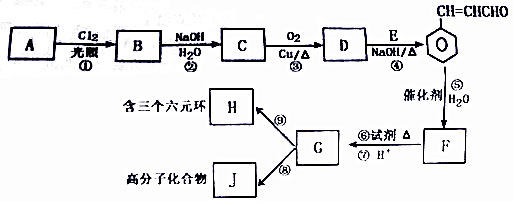
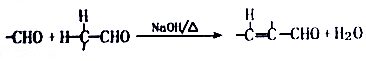
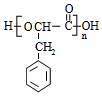 .
.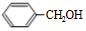 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2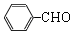 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
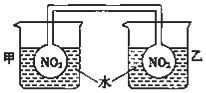 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 | |
| B. | ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 | |
| C. | ③中采用了牺牲阳极的阴极保护法保护桥墩 | |
| D. | ①②③中海水均是实现化学能与电能相互转化的电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
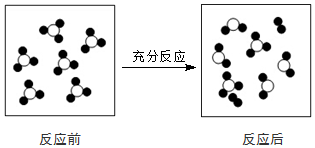
| A. | 一定属于分解反应 | B. | 一定属于氧化还原反应 | ||
| C. | 一定属于放热反应 | D. | 一定属于可逆反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com