
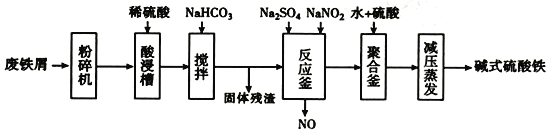
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如下:
已知:
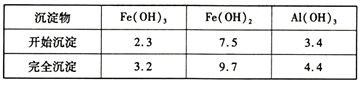
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)粉碎过筛的目的是____________________。
(2)加入少量NaHCO3的目的是________。
(3)反应釜中发生反应的离子方程式为_______________________。在实际生产中,常同时通入02以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为________。
(4)聚合釜中溶液的PH必须控制在一定的范围内。PH偏小时Fe3+水解程度弱,PH偏大时则_____________________________________。
(5)采取减压蒸发的原因是___________________________________。
【答案】 增大反应物接触面积,提高“酸浸”反应速率 调节PH,使溶液中的Al3+沉淀 2H++Fe2++ NO2-=Fe3++NO↑+H20 2mol 形成氢氧化铁沉淀 温度过高,碱式硫酸铁分解
【解析】(1)为提高“酸浸”反应速率,可通过将固体粉碎过筛达到选取细小颗粒,增大反应接触面积来实现。
(2)为了使Fe3+和Al3+完全分离,可通过加入少量NaHCO3来调节溶液pH,使溶液中的Al3+完全沉淀;
(3)反应釜中Fe2+在酸性条件下被NO2-氧化为Fe3+,同时得到还原产物NO时发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O,n(O2)=![]() =0.5mol,则得到电子0.5mol×4=2mol,1mol NaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要2mol NaNO2;
=0.5mol,则得到电子0.5mol×4=2mol,1mol NaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要2mol NaNO2;
(4)为防止Fe3+水解生成Fe(OH)3沉淀,产物不纯,调节溶液pH时不易过大;
(5)蒸发时选择减压蒸发,可降低沸点,避免高温下碱式硫酸铁分解。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. NaHCO3分解过程中,只需克服离子键
B. Na2O溶于水的过程中破坏了离子键和共价键,形成了新的离子键和共价键
C. O3、CO2和SiO2都是由分子构成的
D. 金刚石和足球烯(C60)均为原子晶体,沸点极髙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
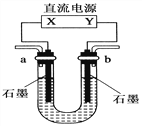
选项 | 电源 X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞试液后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-===2H2O+O2↑ |
C | 负极 | KCl和CuCl2混合溶液 | 相同条件下,a、b两管中产生的气体总体积可能相等 |
D | 负极 | Fe(OH)3胶体和导电液 | b管中液体颜色加深 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①食盐水②二氧化碳③盐酸④蔗糖⑤熔融的硫酸钾⑥氧气⑦纯醋酸⑧金属铜⑨碳酸氢钠固体⑩氢氧化钠固体。请回答下列问题(用序号填写)
(1)能导电的是 __________________________________;
(2)属于电解质的是________________,属于非电解质的是__________________。
(3)写出相关电解质的电离方程式 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将14.2g Na2SO4完全溶于水中,配成500 mL溶液,其物质的量浓度为__________;若从中取出50 mL,Na+物质的量浓度为___________;若将这50 mL溶液用水稀释至100 mL,所得溶液中SO42-的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知标准状况下气体摩尔体积为22.4L/mol,但很多化学实验并非在标准状况下进行,而是在常温常压下进行,下图为测定常温常压下气体摩尔体积的实验装置图。图中反应原理为:2C2H5OH+2Na→2C2H5ONa+H2↑(反应放热)。

(1)①该装置有明显错误处,请指出错误之处:_________;
②作图修改(只针对需修改部位):_____________。
(2)经过(1)改正后进行实验,实验过程如下:
a.检查装置气密性;
b.常温常压下,取4.6g乙醇与足量的金属钠反应并利用排水法收集产生的H2(假设广口瓶和量筒足够大);
c.当圆底烧瓶中不再有气泡产生,不能立即读数,必须先_____,后________,再平视读取量筒中收集到水的体积为1240.0mL。经计算常温常压下气体摩尔体积为__________。
(3)经过(1)改正后仍有实验误差,下列哪些选项会导致实验误差_______。
A.收集到的氢气中含有装置中原有的空气
B.收集H2前导管B中无蒸馏水
C.分液漏斗中的无水乙醇进入圆底烧瓶后占用了装置内气体空间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.4mol·L-1—元酸HA与0.2mol·L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如下图所示。下列说法正确的是

A. HA是弱酸
B. 图中未表示出的微粒的浓度小于0.lmol/L
C. 该混合溶液中:c(HA)+c (X)=c(Na+)
D. 图中M表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com