
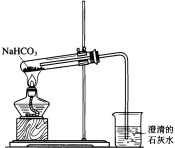
����Ŀ��һѧ�������ͼ��ʾװ�ý���NaHCO3�ķֽ⣬��֤ʵ��������CO2������
��1���Թ��з����Ļ�ѧ��Ӧ����ʽ��____________________________��
��2��ָ����ѧ����Ƶ�װ��ͼ�Ĵ���֮����������������˵�����ɣ�������2����____________��
��3���ձ��з�����Ӧ�����ӷ���ʽ��_______________________________��
��4�������16.8gNaHCO3����һ��ʱ�䣬Ȼ��ʣ���������ˮ��������������CaCl2��Һ�����յõ���ɫ����5.0g����NaHCO3�ֽ�ٷ���Ϊ______________����CaCl2��Ӧ�����ӷ���ʽΪ____________________��
���𰸡�2NaHCO3![]() Na2CO3+CO2��+H2O �Թܿ�Ӧ��������б�������Թܵĵ������̫��������λ��Ӧ���Թܿ�����֮һ���� CO2+Ca2++2OH-��CaCO3��+H2O 50% CO32-+Ca2+��CaCO3��
Na2CO3+CO2��+H2O �Թܿ�Ӧ��������б�������Թܵĵ������̫��������λ��Ӧ���Թܿ�����֮һ���� CO2+Ca2++2OH-��CaCO3��+H2O 50% CO32-+Ca2+��CaCO3��
��������
��1������̼�����Ʒֽ�IJ�����д����ʽ��
��2������װ�úͷ�Ӧ�ص�����жϣ�
��3�����ݶ�����̼�����������Ʒ�Ӧ�������
��4��̼���������Ȼ�����Һ��Ӧ����̼��Ƴ�������Ϸ�Ӧ�ķ���ʽ�������
��1��̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼�����Թ��з�����Ӧ�Ļ�ѧ��Ӧ����ʽ��2NaHCO3![]() Na2CO3+CO2��+H2O��
Na2CO3+CO2��+H2O��
��2����Ӧ����ˮ���ɣ������װ��ͼ��֪�����У��Թܿ�Ӧ��������б�������Թܵĵ������̫��������λ��Ӧ���Թܿ�����֮һ����
��3��̼�����Ʒֽ����������̼��������̼�����������Ʒ�Ӧ�����ձ��з�����Ӧ�����ӷ���ʽ��CO2+Ca2++2OH-��CaCO3��+H2O��
��4��̼�����Ʒֽ�����̼���ƣ�̼���������Ȼ��Ʒ�Ӧ����̼��Ƴ�������Ӧ�����ӷ���ʽΪCO32-+Ca2+��CaCO3����̼��Ƶ����ʵ�����5.0g��100g/mol��0.05mol����̼���Ƶ����ʵ�����0.05mol����˸��ݷ���ʽ2NaHCO3![]() Na2CO3+CO2��+H2O��֪����̼������0.1mol��������8.4g������NaHCO3�ֽ�ٷ���Ϊ8.4g/16.8g��100%��50%��
Na2CO3+CO2��+H2O��֪����̼������0.1mol��������8.4g������NaHCO3�ֽ�ٷ���Ϊ8.4g/16.8g��100%��50%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������һ������ȱ����ƶѪ�İ�ȫ��Ч�����Ƽ������������ʵ���pH��������![]() ����Ӧ�ø�����������
����Ӧ�ø�����������
��֪��
�������� | ��ѧʽ | ��Է������� | ���볣��(25��) |
������ |
| 116 |
|
̼�� |
|
| |
���������� | FeC4H2O4 | 170 |
i.�Ʊ�������������
�ٽ�����������100mL�ձ�A�У�����ˮ����
�ڼ���![]() ��Һ10mLʹ��ҺpHΪ6.5-6.7������������Һ����100mL����B��
��Һ10mLʹ��ҺpHΪ6.5-6.7������������Һ����100mL����B��
�۰�װ�û���װ��C���������С�Ȼ��ͨ����ѹ��Һ©��D��������![]() ��Һ30mL
��Һ30mL
��ά�ַ�Ӧ�¶�100�棬��ֽ���1.5Сʱ����ȴ����ѹ���ˣ���ˮϴ�ӳ���
�����ˮԡ������غ�(����)ɫ��ĩ����¼����
��ش��������⣺
(1)��ʵ���漰������Ҫ����������ϸ���ѡ����BΪ__________(����ĸ)��CΪ___________(������)��
(2)��֪��Ӧ�����з�Ӧ��![]() �����ᰴǡ����ȫ��Ӧ�ı���������ʼͶ�ϣ�д��������м���
�����ᰴǡ����ȫ��Ӧ�ı���������ʼͶ�ϣ�д��������м�����Һ����pH��Ŀ����______________________________________________��������
![]() ��Һ��������ҺpHƫ�ߣ����Ƶò�Ʒ�Ĵ��Ȼ�_____________(����ƫ������ƫ����������Ӱ����)��
��Һ��������ҺpHƫ�ߣ����Ƶò�Ʒ�Ĵ��Ȼ�_____________(����ƫ������ƫ����������Ӱ����)��
(3)����![]() ��Һ����Ϊ��ȡ
��Һ����Ϊ��ȡ![]() ���壬����30mL����й�����ˮ�У���������й�����ˮ��ԭ����____________________________________________________________________________��
���壬����30mL����й�����ˮ�У���������й�����ˮ��ԭ����____________________________________________________________________________��
(4)�������ϴ�ӵ�Ŀ����Ҫ��Ϊ�˳�ȥ��___________���ӣ���������Ƿ�ϴ���ķ����ǣ�_____________��
ii.�����Ʒ�IJ��ʣ�
(5)���ⶨ����Ʒ�и����������Ĵ���Ϊ76.5%����5.80g������Ϊԭ�Ϸ�Ӧ�Ƶò�Ʒ8.10g�������������IJ���Ϊ_____________%��(����С�����һλ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����������һ����ͬ����(����)
A. 1 g H2��8 g O2
B. 0.1 mol HCl��2.24 L He
C. 150 �棬1.01��105 Paʱ��18 L H2O��18 L CO2
D. ���³�ѹ�£�28 g CO��6.02��1022��CO����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������NOx����ҪָNO��NO2�����γ����ꡢ�⻯ѧ�������ƻ������㣬�Ǵ�����Ҫ��Ⱦ��֮һ����Чȥ�������е�NOx�ǻ�����������Ҫ���⡣
(1)�о����������������ڴ����к������ӵ������ʱ���漰���·�Ӧ:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)��K1����H1<0��(��)
NaNO3(s)+ClNO(g)��K1����H1<0��(��)
2NO(g)+Cl2(g)![]() 2ClNO(g)��K2����H2<0��(��)
2ClNO(g)��K2����H2<0��(��)
��4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)��ƽ�ⳣ��K=____(��K1��K2��ʾ)��
2NaNO3(s)+2NO(g)+Cl2(g)��ƽ�ⳣ��K=____(��K1��K2��ʾ)��
��Ϊ�о���ͬ�����Է�Ӧ(��)��Ӱ�죬�ں��������£���2 L�����ܱ������м���0.2 mol NO��0.1 mol Cl2��10 minʱ��Ӧ(��)�ﵽƽ�⡣���10 min����(ClNO)=7.5��10-3mol��L-1��min-1����ƽ���NO��ת������1=____�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½��У�ƽ��ʱNO��ת������2____��1(����>����<������=��)��ƽ�ⳣ��K2____(��������������С������������)��
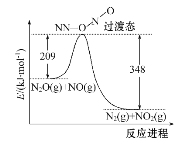
(2)NO����N2O��Ӧ����N2��NO2����Ӧ�������仯����ͼ��ʾ��������1 mol N2���䦤H=____kJ��mol-1��
(3)NH3����ԭ��������(SCR)������ĿǰӦ����㷺���������������ѳ���������Ӧԭ����ͼ����ʾ��
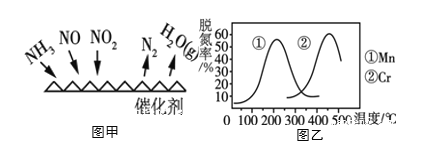
����ͼ��֪��SCR�����е�������Ϊ_____________����NO2��NO�����ʵ���֮��Ϊ1:1ʱ��������������һ�������·����ѵ���Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��ͼ���Dz�ͬ����Mn��Cr�ڲ�ͬ�¶��¶�Ӧ���ѵ��ʣ���ͼ��֪��ҵѡȡ����Ѵ���Ϊ________��
(4)���õ绯ѧװ�ÿ���������������Ⱦ�����Ϊ����ͼ��װ��ʵ�ֵ�����ת����ʽ��_______��ͼ��Ϊ���NO�Ʊ�NH4NO3��װ�ã���װ���������ĵ缫��ӦʽΪ___________________��
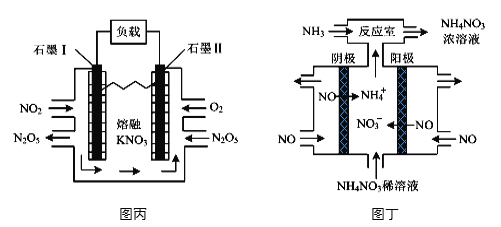
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ���ǣ�������
A.ʵ������Ũ�����MnO2��ϼ�����Cl2��MnO2+4H++2Cl��![]() Mn2++Cl2��+2H2O
Mn2++Cl2��+2H2O
B.��Cl2����ˮ�Ʊ������Cl2+H2O��2H++Cl��+ClO��
C.�ù�����NaOH��Һ����SO2��OH��+SO2��HSO3��
D.��AlCl3��Һ�м��백ˮ��Al3++3OH����Al��OH��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ּ�����ͼ��ʾ���ܱ������з����й����Լ�������λ��, ����������������Ӧ��ȫ�һָ���ԭ�����¶ȣ�U�ι���������Һ����ƽ�������й�˵���д������

A. ��Ӧǰ��װ���ڿ����ijɷֱ��ֲ���
B. ��Ӧǰװ��������Ag2O���ʵ���֮��Ϊ2:1
C. ���ȶ��ԣ����ɵ��Ƶ�������ǿ��Ag2O
D. ��Ӧ���е���ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���� (�� ��)
A.�������������Ʊ��Ļ�ѧ����ʽΪ��FeCl3+H2O![]() Fe(OH) 3 ��+3HCl
Fe(OH) 3 ��+3HCl
B.�����������Һ�м���Ba(OH)2��Һ��������2H++SO42-+Ba2��+2OH-=BaSO4��+2H2O
C.��������ͨ���廯������Һ�У�Cl2+2Br- =Br2+2Cl-
D.��Fe(OH)3�������2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 mL��BaCl2��KCl�Ļ����Һ�ֳ�2�ȷݣ�һ�ݼ��뺬a mol�����Ƶ���Һ��ǡ��ʹ��������ȫ��������һ�ݼ��뺬b mol����������Һ��ǡ��ʹ��������ȫ��������û����Һ�м�����Ũ��Ϊ
A.0.1(b-2a)mol/LB.0.4( 2a-b)mol/L
C.10(b-2a)mol/LD.4(b-2a)mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɾ۱�ϩ����ά�ķ����ܶ࣬������ȲΪԭ�ϣ���ϳɹ��̵Ļ�ѧ��Ӧ����ʽ���£�
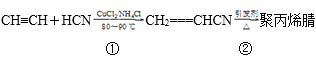
��1����Ӧ�ٵķ�Ӧ����Ϊ___��
��2��д����Ӧ�ڵĻ�ѧ����ʽ��___���䷴Ӧ����Ϊ__��
��3��1mol�ϳɾ۱�ϩ��ĵ�����һ���������������___molH2�ӳɡ�
��4��CH2===CHCN��һ�������¿��뱽��ϩ(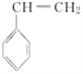 )��Ӧ�õ�һ�����������ϣ������ϵĽṹ��ʽΪ___��
)��Ӧ�õ�һ�����������ϣ������ϵĽṹ��ʽΪ___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com