
| A. | (CH3COO-)<c(Na+) | B. | c(CH3COOH)>c(CH3COO-) | ||
| C. | 2c(H+)=c(CH3COO-)-c(CH3COOH) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
分析 把0.02mol/L CH3COOH溶液和0.01mol/L NaOH溶液等体积混合,得到等浓度的CH3COOH、CH3COONa混合溶液.
A.CH3COOH的电离程度大于中CH3COO-离子水解程度;
B.CH3COOH的电离程度大于中CH3COO-离子水解程度;
C.由电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-),物料守恒2c(Na+)=c(CH3COOH)+c(CH3COO-),联立判断;
D.根据C原子守恒(物料守恒)判断.
解答 解:把0.02mol/L CH3COOH溶液和0.01mol/L NaOH溶液等体积混合,得到等浓度的CH3COOH、CH3COONa混合溶液.
A.CH3COOH的电离程度大于中CH3COO-离子水解程度,则(CH3COO-)>c(Na+),故A错误;
B.CH3COOH的电离程度大于中CH3COO-离子水解程度,则c(CH3COOH)<c(CH3COO-),故B错误;
C.由电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-),物料守恒2c(Na+)=c(CH3COOH)+c(CH3COO-),联立可得:2c(H+)=(CH3COO-)+2 c(OH-)-c(CH3COOH),故C错误;
D.混合后为0.05mol/LCH3COOH溶液和0.05mol/LCH3COONa溶液,由物料守恒可知c(CH3COOH)+c(CH3COO-)=c(Na+)×2=0.01mol/L,故D正确.
故选:D.
点评 本题考查溶液中离子的浓度大小比较,对于混合溶液先判断混合后溶质情况,再结合弱电解质电离、水的电离、盐类水解以及电荷守恒、微粒守恒等进行判断,离子浓度等量关系判断常利用电荷守恒、物料守恒、质子恒等式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
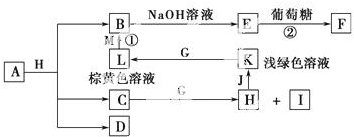
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
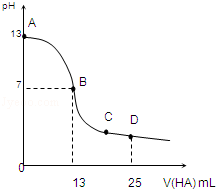 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
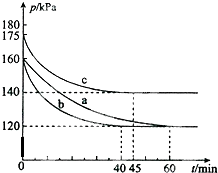 在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )
在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )| A. | 与实验a相比,实验b升高了温度,实验c加入了催化剂 | |
| B. | 从反应开始至刚达平衡时,实验b的化学反应速率ν(PCl5)=5×10-4mol/(L.min) | |
| C. | 实验c达平衡时,PCl3(g)的转化率为 60% | |
| D. | 在实验a条件下,该反应的平衡常数K=100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液具有漂白性是因为空气中的CO2与消毒液中的NaClO反应生成HClO | |
| B. | “乙醇汽油”是向汽油中添加了一定比例的乙醇,该混合燃料的热值也发生了改变 | |
| C. | 用聚乳酸塑料代替聚乙烯塑料可减少白色污染 | |
| D. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 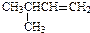 2-甲基-3-丁烯 2-甲基-3-丁烯 | B. | 乙炔的结构简式:CHCH | ||
| C. | 乙醚的分子式:C 2H 6O | D. | 甲基的电子式: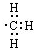 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com