

 、C
、C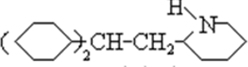 .
. .
.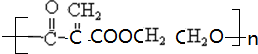 .
. .
. 分析 根据流程图中苯转化为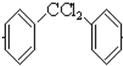 ,为四氯化碳中的两个氯原子被苯环上的碳取代,同一碳上的羟基不稳定,所以卤代烃水解消去得到酮
,为四氯化碳中的两个氯原子被苯环上的碳取代,同一碳上的羟基不稳定,所以卤代烃水解消去得到酮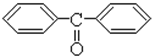 ,根据酮和A反应生成
,根据酮和A反应生成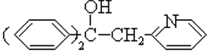 ,推之酮和A发生加成反应的产物,所以A为:
,推之酮和A发生加成反应的产物,所以A为: ,
,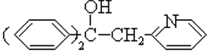 在浓硫酸的作用下发生醇羟基的消去反应生成B
在浓硫酸的作用下发生醇羟基的消去反应生成B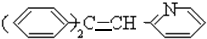 ,和氢气发生加成反应生成C
,和氢气发生加成反应生成C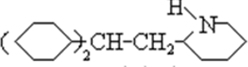 ,C与D反应生成心舒宁,所以D为:
,C与D反应生成心舒宁,所以D为: ,
,
(1)反应①为四氯化碳中的两个氯原子被苯环上的碳所取代的反应;反应②为醇羟基的消去反应;
(2)分别根据反应①、③分析A、C的结构简式;
(3)B为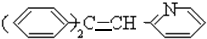 ,苯环、碳氮双键、碳碳双键都能与氢气发生加成反应;如果将 ③、④两步颠倒,则最后得到的产物无不饱和碳碳键;
,苯环、碳氮双键、碳碳双键都能与氢气发生加成反应;如果将 ③、④两步颠倒,则最后得到的产物无不饱和碳碳键;
(4)D为: ,同类别的同分异构体含有碳碳双键、羧基,所以为
,同类别的同分异构体含有碳碳双键、羧基,所以为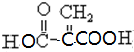 ,与乙二醇发生缩聚反应为醇羟基和羧基的反应;
,与乙二醇发生缩聚反应为醇羟基和羧基的反应;
(5)A为: ,与A的属于芳香族化合物为苯胺,氨基与盐酸反应;
,与A的属于芳香族化合物为苯胺,氨基与盐酸反应;
解答 解:据流程图中苯转化为 ,为四氯化碳中的两个氯原子被苯环上的碳取代,CCl4+2
,为四氯化碳中的两个氯原子被苯环上的碳取代,CCl4+2 $\stackrel{催化剂}{→}$$\stackrel{一定条件}{→}$
$\stackrel{催化剂}{→}$$\stackrel{一定条件}{→}$ +2HCl,同一碳上的羟基不稳定,所以卤代烃水解消去得到酮
+2HCl,同一碳上的羟基不稳定,所以卤代烃水解消去得到酮 ,根据酮和A反应生成
,根据酮和A反应生成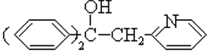 ,推之酮和A发生加成反应的产物,
,推之酮和A发生加成反应的产物, +
+ $\stackrel{一定条件}{→}$→
$\stackrel{一定条件}{→}$→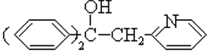 ,A为:
,A为: ,
,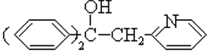 在浓硫酸的作用下发生醇羟基的消去反应
在浓硫酸的作用下发生醇羟基的消去反应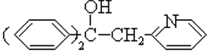 $→_{△}^{浓硫酸}$$→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$$→_{△}^{浓硫酸}$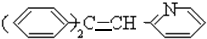 +H2O,生成B
+H2O,生成B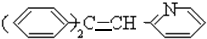 ,和氢气发生加成反应
,和氢气发生加成反应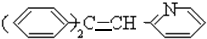 +10H2$\stackrel{一定条件}{→}$$\stackrel{催化剂}{→}$
+10H2$\stackrel{一定条件}{→}$$\stackrel{催化剂}{→}$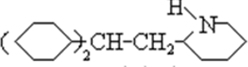 ,生成C
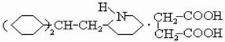
,生成C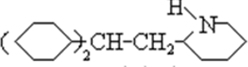 ,C与D反应生成心舒宁,所以D为:
,C与D反应生成心舒宁,所以D为: ,反应为:
,反应为: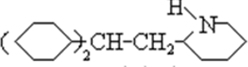 +
+ →
→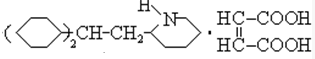 ,
,
(1)反应①为四氯化碳中的两个氯原子被苯环上的碳所取代的反应:CCl4+2 $\stackrel{催化剂}{→}$$\stackrel{一定条件}{→}$
$\stackrel{催化剂}{→}$$\stackrel{一定条件}{→}$ +2HCl,
+2HCl,
反应②为醇羟基的消去反应: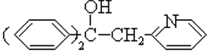 $→_{△}^{浓硫酸}$$→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$$→_{△}^{浓硫酸}$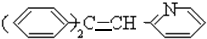 +H2O,
+H2O,
故答案为:取代反应;消去反应;
(2)反应①为四氯化碳中的两个氯原子被苯环上的碳所取代的反应:CCl4+2 $\stackrel{催化剂}{→}$$\stackrel{一定条件}{→}$
$\stackrel{催化剂}{→}$$\stackrel{一定条件}{→}$ +2HCl,所以A为:
+2HCl,所以A为: ,
,
反应③为B和氢气的加成反应,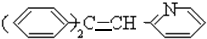 +H2$\stackrel{一定条件}{→}$$\stackrel{催化剂}{→}$
+H2$\stackrel{一定条件}{→}$$\stackrel{催化剂}{→}$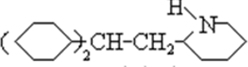 ,生成C
,生成C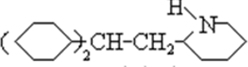 ,
,
故答案为: ;
;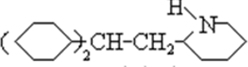 ;
;
(3)B为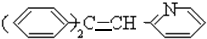 ,苯环、碳氮双键、碳碳双键都能与氢气发生加成反应,反应为:
,苯环、碳氮双键、碳碳双键都能与氢气发生加成反应,反应为: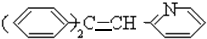 +10H2$\stackrel{一定条件}{→}$$\stackrel{催化剂}{→}$
+10H2$\stackrel{一定条件}{→}$$\stackrel{催化剂}{→}$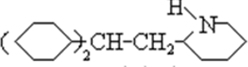 ,由1mol B转化为C,消耗H2的物质的量为10mol,
,由1mol B转化为C,消耗H2的物质的量为10mol,
如果将③、④两步颠倒,则发生反应为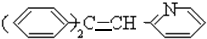 先与
先与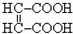 生成盐,后再与H2加成,故最后得到的产物的结构简式中应不含不饱和的碳碳双键.即为
生成盐,后再与H2加成,故最后得到的产物的结构简式中应不含不饱和的碳碳双键.即为 ,
,
故答案为:10mol; ;
;
(4)D为: ,同类别的同分异构体含有碳碳双键、羧基,所以为
,同类别的同分异构体含有碳碳双键、羧基,所以为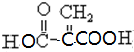 ,与乙二醇发生缩聚反应n
,与乙二醇发生缩聚反应n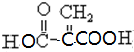 +nCH2OH-CH2OH$\stackrel{一定条件}{→}$
+nCH2OH-CH2OH$\stackrel{一定条件}{→}$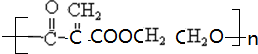 +( n-1)H2O,所得产物的结构简式为
+( n-1)H2O,所得产物的结构简式为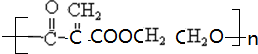 ,
,
故答案为: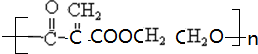 ;
;
(5)A为: ,与A的属于芳香族化合物为苯胺,氨基与盐酸反应:
,与A的属于芳香族化合物为苯胺,氨基与盐酸反应: ,
,
故答案为: .
.
点评 本题考查有机物的合成,题目难度中等,注意分子式的确定,注意把握官能团和性质的关系,熟悉醛、醇、苯的性质是解答本题的关键.


科目:高中化学 来源: 题型:多选题

| A. | 等体积的三种酸与足量Mg反应,HX放出气体的体积最小 | |
| B. | 三种酸等体积混合后与NaOH溶液反应,当HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+) | |
| C. | 根据曲线,可得0.1mol•L-1HX溶液中由水电离出的c(H+)为10-4mol•L-1 | |
| D. | 将HY与HZ的稀溶液混合后所得溶液中:c(H+)=$\frac{{K}_{a}(HY)•c(HY)}{c({H}^{+})}$+c(Z-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
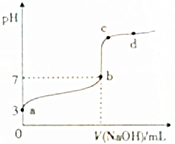 常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中:c(H+)>c(CH3COO-)>c(OH-) | |
| B. | b点时,V(NaOH)=20mL | |
| C. | c点表示的溶液中:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) | |
| D. | d点表示的溶液中:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序是Z>W>Y>X | |
| B. | 元素的非金属性W>Y>X | |
| C. | Z2Y3、WX分别是离子化合物、共价化合物 | |
| D. | X、Z、W的最高价氧化物都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 pH 试纸检验气体,一般先将 pH试纸用蒸馏水湿润,粘在玻璃棒的一端,并使其接近出气口,观察颜色的变化 | |
| B. | 检验 Fe3O4中是否含+2价铁元素时,先用盐酸溶解Fe3O4,再用 KMnO4溶液检验 | |
| C. | 海带中碘元素的提取和检验实验中为制取海带灰的浸取液,需要煮沸1-2min,其主要目的是赶走溶液中的溶解氧,避免氧气氧化碘离子 | |
| D. | 检验麦芽糖水解的产物时,先向水解后的溶液中加入氢氧化钠溶液至碱性,再加入新制的银氨溶液并水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
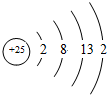 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | ①②④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com