
已知下列热化学方程式:
① Fe2O3(s)+ 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s)+ CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
A.Fe3O4+ 4CO = 3Fe + 4CO2 △H= -14kJ·mol-1
B.Fe3O4(s)+ 4CO(g) = 3Fe(s) + 4CO2(g) △H= -22kJ·mol-1
C.Fe3O4(s)+ 4CO(g) = 3Fe(s) + 4CO2(g) △H= +14kJ·mol-1
D.Fe3O4(s)+ 4CO(g) = 3Fe(s) + 4CO2(g) △H= -14kJ·mol-1
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
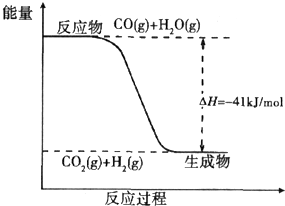 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com