

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b连接时,铜片上发生氧化反应 |
分析 A、a和b不连接时,Fe与硫酸铜溶液发生置换反应;
B、a和b用导线连接时,形成原电池,铜离子在正极得电子;
C、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu;
D、a和b用导线连接时,形成原电池,铜为正极,发生还原反应.
解答 解:A、a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,所以铁片上会有金属铜析出,故A正确;
B、a和b用导线连接时,形成了原电池,铜作正极,发生的反应为:Cu2++2e-=Cu,故B正确;
C、a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,a和b用导线连接时,形成了原电池,加快了铁将金属铜从其盐中置换出来的速度,无论a和b是否连接,铁片均会溶解,溶液从硫酸铜的蓝色逐渐变成硫酸亚铁的浅绿色,故C正确;
D、a和b用导线连接时,形成原电池,铁为负极,铁失电子逐渐溶解,铜离子在正极铜上得电子,所以铜片上发生还原反应,故D错误.
故选D.
点评 本题考查学生化学反应与原电池反应,其本质都是氧化还原反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
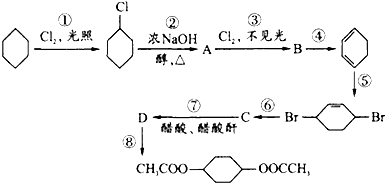
 ,C
,C .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径(×10-10m) | 1.60 | 1.86 | 0.75 | 0.74 | 1.02 |
| 主要化合价 | +2 | +1 | +5,-3 | -2 | +6,-2 |
| A. | Z的最高价氧化物对应的水化物与其最简单氢化物反应生成的化合物中含离子键和极性键 | |
| B. | 最简单氢化物的稳定性:Z>M | |
| C. | 最简单氢化物的沸点高低顺序为:R>M | |
| D. | 最高价氧化物对应水化物的碱性强弱顺序为:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -317.3 kJ•mol-1 | B. | -379.3 kJ•mol-1 | C. | +317.3 kJ•mol-1 | D. | +379.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com