
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l) △H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l) △H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A.Q1+ Q2+Q3 B.0.5(Q1+Q2+Q3 )
C.0.5 Q1-1.5 Q2+0.5Q3 D.1.5 Q1-0.5 Q2+0.5Q3
科目:高中化学 来源:2015届湖南省益阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
脑白金又名褪黑素,据报道它具有提高免疫力、促进睡眠等功效,其结构简式为:
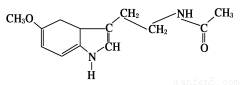
下列关于脑白金说法不正确的是( )
A.能发生加成反应
B.属于芳香族化合物
C.分子式为C13H18N2O2
D.能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应: Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
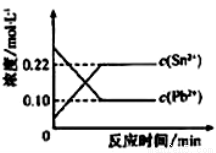
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应的△H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
常温下的下列情况中,一定能大量共存于同一溶液中的离子组是
A.使甲基橙呈红色的溶液中:S2-、Cl-、NO3-、Na+
B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3-
C.由水电离出的c(H+)=1×10 -12 mol·L -1的溶液中:K+、Cl-、NO3-、Na+
D.在0.1mol/L的氯化铁溶液中:Ⅰ一、NH4+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol·L-1与B mol·L-1,则A和B的关系为
A.A>B B.A=10-4B C.B=10-4A D.A=B
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:填空题
如图为相互串联的甲、乙两电解池。试回答:
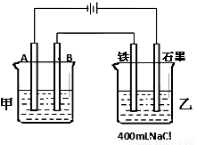
(1)若甲电解池利用电解原理在铁上镀铜,则A是 、 (填电极材料和电极名称),电极反应是 ;B是(要求同A) 、 ,电极反应是 ,应选用的电解质溶液是 ;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下的下列情况中,一定能大量共存于同一溶液中的离子组是
A.使甲基橙呈红色的溶液中:S2-、Cl-、NO3-、Na+
B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3-
C.由水电离出的c(H+)=1×10 -12 mol·L -1的溶液中:K+、Cl-、NO3-、Na+
D.在0.1mol/L的氯化铁溶液中:Ⅰ一、NH4+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:填空题
(8分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。

试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_____________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源:2015届湖北省三校高二上学期期末联考化学试卷(解析版) 题型:实验题
Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和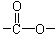 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯(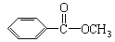 )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| 熔点 ℃ | 沸点 ℃ | 水溶性 |
甲醇 | —97.8 | 64.7 | 易溶 |
苯甲酸(一元弱酸) | 122.4 | 249.3 | 常温:0.17g;100℃:6.8g |
苯甲酸甲酯 | —12.3 | 198 | 难溶 |
合成苯甲酸甲酯的流程如下:

请回答下列问题:
(1)温度①约为_________℃,操作③为_________,操作④为__________。
(2)第②步加热的目的是______________________________________。
(3)选择合适的制备苯甲酸甲酯的装置:______________。
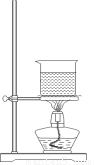
A B C D
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式_______。①为芳香化合物 ②含有醛基 ③能与金属Na反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com