
| ||
| m |
| M |
| ||
| 168×15.5g |
| 62 |
| 14.35g |
| 143.5g/mol |


科目:高中化学 来源: 题型:
| A、能与水反应 |
| B、能与氢氧化钠溶液反应 |
| C、能与硫酸反应 |
| D、能与碳酸钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
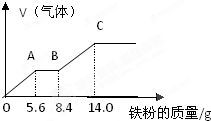 某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)
某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙烷中混有的少量乙烯:通入溴水,干燥 |
| B、除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液 |
| C、除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 |
| D、除去乙醇中的微量水可加入金属钠,使其完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A、平衡常数K:容器Ⅱ>容器Ⅲ | ||
| B、反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ | ||
C、反应到达平衡时,容器I中的平均速率为v(PCl5)=
| ||
| D、起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  | 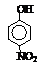 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有离子键的化合物一定是离子化合物 |
| B、含有共价键的化合物一定是共价化合物 |
| C、共价化合物中一定含有极性共价键,肯定不含离子键 |
| D、离子化合物一定含有离子键,可能含有共价键. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com