
高温下,某反应达平衡,平衡常数K=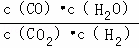 .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
|
| A. | 该反应的焓变为正值 |
|
| B. | 恒温恒容下,增大压强,H2浓度一定减小 |
|
| C. | 升高温度,逆反应速率减小,平衡常数K增大 |
|
| D. | 该反应化学方程式为CO+H2O |
考点:
化学平衡的影响因素.
专题:
化学平衡专题.
分析:
平衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数K= ,所以该反应化学方程式应为CO2+H2
,所以该反应化学方程式应为CO2+H2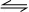 CO+H2O,恒容时,温度升高,H2浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
CO+H2O,恒容时,温度升高,H2浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
A、恒容时,温度升高,H2浓度减小,平衡向正反应移动,并且升高温度平衡向吸热反应移动;
B、恒温恒容下,增大压强,分析引起压强增大的可能原因进行判断;
C、温度升高,正逆反应都增大;
D、根据平衡常数表达式书写反应方程式.
解答:
解:平衡常数K= ,所以该反应化学方程式应为CO2+H2
,所以该反应化学方程式应为CO2+H2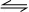 CO+H2O.
CO+H2O.
A、恒容时,温度升高,H2浓度减小,平衡向正反应移动,且该方向是吸热的,所以该反应的△H>0,故A正确;
B、恒温恒容下,增大压强,如是加入稀有气体的话,各物质浓度没有变,所以平衡不移动,此时各物质的浓度不会变化,故C错误;
C、升高温度,正、逆反应速率都增大,故C错误;
D、由平衡常数可知,该反应为CO2+H2 CO+H2O,故D错误.
CO+H2O,故D错误.
故选A.
点评:
本题考查化学平衡常数、影响化学平衡的因素等,难度中等,注意对化学反应来说引起压强增大的原因不是唯一的.


科目:高中化学 来源: 题型:
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体
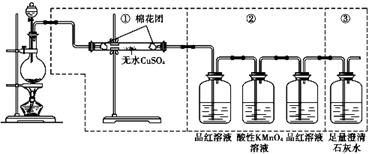 |
(1)如果装置中①.②.③三 部分仪器的连接顺序改为②.①.③,则可以检验出的物
质是 ;不能检出的物质是 。
(2)如果将仪器的连接顺序变
为①.③.②,则可以检出的物质是 ;不能检出的物质是 。
(3)如果将仪器的连接顺序变为②.③.①,则可以检出的物质是 ;不能检出的物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
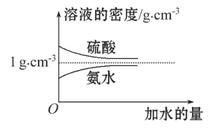
| 溶质的物质的量 浓度/mol·L-1 | 溶液的密度 /g·cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol·L-1。
(3)物质的量浓度为c2mol·L-1的氨水与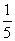 c2mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度
c2mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度 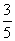 c2mol·L-1(设混合后溶液的体积变化忽略不计)。
c2mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
|
| B. | 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
|
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
|
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,反应SO2(g)+ O2(g)⇌SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)⇌2SO2(g)+O2(g)的平衡常数K2的值为( )
O2(g)⇌SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)⇌2SO2(g)+O2(g)的平衡常数K2的值为( )
|
| A. | 2500 | B. | 100 | C. | 4×10﹣4 | D. | 2×10﹣2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在5L的密闭容器中充入2mol A气体和1mol B气体,在一定条件下发生反应:2A(g)+B(g)⇌2C(g),达到平衡时,在相同温度下测得容器内混合气体的压强是反应前的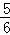 ,试求:
,试求:
(1)平衡时A的浓度
(2)A的转化率.
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去KCl中的Ca2+,Mg2+,SO42﹣及泥沙,得到纯净的KCl,可将固体溶于水,然后在下列操作中选取必要的步骤和最佳的操作顺序( )
①过滤 ②加过量KOH溶液 ③加适量盐酸 ④加过量K2CO3溶液 ⑤加过量BaCl2溶液.
|
| A. | ②①⑤①④①③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol•L﹣1.
(2)取用任意体积的该盐酸溶液时,下列物理量中,不随取用的体积多少而变化的是 .
A.HCl的摩尔质量 B.溶液的浓度
C.溶液中Cl﹣的质量分数 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.4mol•L﹣1的稀盐酸.
①该学生需选择容量瓶的规格为 mL;(填:100、250、500、1000)
该学生需要量取 ml 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
Ⅰ.用量筒量取浓盐酸时,俯视观察凹液面
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(填:“偏大”、“偏小”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
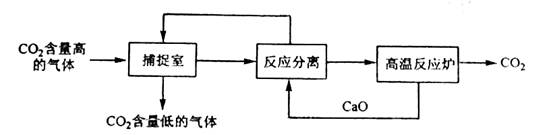
下列有关该方法的叙述中正确的是
A.能耗大是该方法的一大缺点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com