
科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而实现预期目的。下列判断错误的是
A.废水处理时铝单质转化为Al3+ B.废水处理中,亚硝酸盐被还原
C.处理过程中,OH一参与了反应 D.铝粉颗粒大小影响废水处理的速率
科目:高中化学 来源: 题型:
已知:某温度时,KW=1.0×10-12。在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-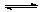 H++A2-
H++A2-
B.常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-)
C.相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等
D.0.0l mol·L-l的NaHA溶液pH>2
查看答案和解析>>
科目:高中化学 来源: 题型:
、三氟化氮(NF3)是无色无味气体,它可由氨气和氟气反应制得:4NH3+3F2===NF3+3NH4F。下列说法正确的是
A、NH4F的还原性比NH3强
B、NF3的氧化性比F2强
C、该反应中被氧化和被还原物质的物质的量之比为4∶3
D、该反应中得到1 mol NF3时,转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
写出符合要求的化学方程式或离子方程式:
(1)实验室用二氧化锰和浓盐酸制备氯气的离子方程式_______________________________。
(2)用苯制备硝基苯的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如下图所示。(部分生成物和反应条件已略去)
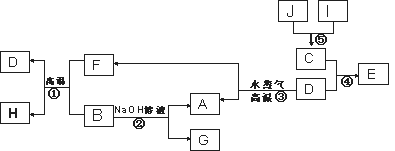
请回答下列问题:
(1) 写出组成物质D的元素在周期表中的位置:___________________。
(2) ①写出反应①的化学方程式:______________________________。
②由E的饱和溶液可以制得胶体,用化学方程式表示该过程的原理是_______________。
③写出反应②的离子方程式_________________________________。
(3) 已知G的水溶液显碱性,其原因是(用离子方程式表示)_________。
(4) J在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用NaNO2+NH4Cl=NaCl+N2↑+2H2O制备N2,下列说法正确的是( )
A.NaNO2发生氧化反应
B.NH4Cl中的氮元素被还原
C.N2既是氧化产物,又是还原产物
D.每生成1mol N2转移电子的物质的量为6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中。
(1)镁在元素周期表中的位置为_________________________.
(2)写出用镁与金红石(主要成分为Ti O2)在加热条件下制取钛的化学方程式:_____________________________________.
(3)镁在加热的条件下还能与NaOH固体反应,生成MgO和单质X、单质Y。已知X与水反应可生成单质Y,则镁与NaOH反应的化学方程式为____________________.
(4)镁—过氧化氢电池的工作原理如图所示,该电池放电时总反应的化学方程式为______________________________________.
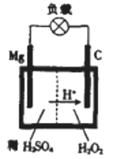
查看答案和解析>>
科目:高中化学 来源: 题型:
由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:

(1)电解生成的铝在熔融液的 (填“上层”或“下层”),电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式: 。
(3)电解制 备铝时,需加入冰晶石(Na3AlF6),其作
备铝时,需加入冰晶石(Na3AlF6),其作 用是 ,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式: 。
用是 ,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式: 。
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是 (填化学式),阳极的电极反应为  。
。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见下图),此时铝表面可形成耐酸的致密氧化膜,其电极反应为 ;

②钢材镀铝后,能防止钢材腐蚀,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白。过氧化氢法生产亚氯酸钠的流程图如下
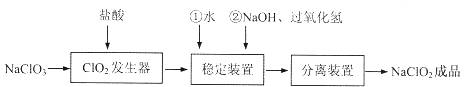
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为
(2)在NaClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验后顺序填写操作代号)。
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO-2能被I完全还原成Cl—;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6。
欲测定成品中NaClO2的含量,现进行如下操作:

①步骤Ⅱ中发生反应的离子方程式是 ,
步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数 (用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com