
| A. | Va>Vb时:c (CH3COOH)>c (CH3COO-)>c (K+) | |
| B. | Va=Vb时:c (CH3COOH)+c (H+)>c (OH-) | |
| C. | Va<Vb时:c (CH3COO-)>c (K+)>c (OH-)>c (H+) | |
| D. | Va与Vb任意比时:c (K+)+c (H+)=c (OH-)+c (CH3COO-) |
分析 A.Va>Vb时,混合溶液中溶质为CH3COOH、CH3COOK,且醋酸电离程度大于醋酸根离子水解程度,如果n(CH3COOH)远远大于n(CH3COOK),可存在c (CH3COOH)>c (CH3COO-);
B.Va=Vb时,混合溶液中溶质为醋酸钾,溶液中存在质子守恒,根据质子守恒判断;
C.Va<Vb时,混合溶液中溶质为醋酸钾和KOH,如果n(CH3COOK)>n(KOH),根据物料守恒知,c (CH3COO-)<c (K+);
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.Va>Vb时,混合溶液中溶质为CH3COOH、CH3COOK,且醋酸电离程度大于醋酸根离子水解程度,如果n(CH3COOH)远远大于n(CH3COOK),可存在c (CH3COOH)>c (CH3COO-),醋酸电离出醋酸根离子导致溶液中c (CH3COO-)>c (K+),所以可以存在c (CH3COOH)>c (CH3COO-)>c (K+),故A正确;
B.Va=Vb时,混合溶液中溶质为醋酸钾,溶液中存在质子守恒,根据质子守恒得c(CH3COOH)+c(H+)=c(OH-),故B错误;
C.Va<Vb时,混合溶液中溶质为醋酸钾和KOH,如果n(CH3COOK)>n(KOH),根据物料守恒知,c (CH3COO-)<c (K+),且“c (CH3COO-)>c (K+)>c (OH-)>c (H+)”不遵循电荷守恒,故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c (K+)+c (H+)=c (OH-)+c (CH3COO-),故D正确;
故选BC.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确混合溶液中溶质成分、溶质性质及酸碱物质的量相对大小是解本题关键,注意溶液中存在电荷守恒和物料守恒与溶液中溶质成分多少无关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化 | |
| B. | “曾青得铁化为铜”发生了化学变化 | |
| C. | “滴水石穿、绳锯木断”不包含化学变化 | |
| D. | “卤水点豆腐,一物降一物”的前半句话与胶体知识有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应就是不可能发生的反应,自发反应就是能较快进行的反应 | |
| B. | 高温高压下可以使石墨转化为金刚石是自发的化学反应 | |
| C. | 由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,说明该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
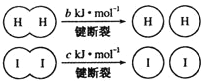
| A. | 向密闭容器中加入1 mol H2(g)和2mol I2(g),充分反应后放出的热量有可能等于a kJ | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 断开1 mol I-I键的同时形成2mol H-I键,说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8和C5H10 | B. | C3H8和C4H10 | ||
| C. | C2H4O2和C3H6O2 | D. | C6H5OH和C6H5CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
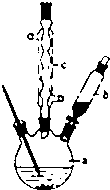 苯乙酸铜是合成优良催化剂、传感材料-纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料-纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: (苯乙腈)
(苯乙腈)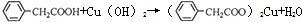
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
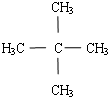 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com