
【题目】Ⅰ.某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:
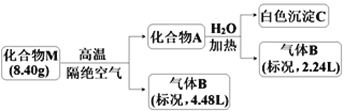
已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是______________(用元素符号表示)。
(2)化合物A与水反应的化学方程式是______________________。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是______。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为___________________________。
(5)X的化学式_____________。
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式___________________。
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式_____________________。
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式________,判断该同学设计的验证方法合理性并说明理由_________。
【答案】Mg、N、H Mg3N2 + 6H2O == 3Mg(OH)2↓+ 2NH3↑ Mg+2NH3![]() Mg(NH2)2+H2↑
Mg(NH2)2+H2↑ ![]() Na2S2O8 2NaHSO4
Na2S2O8 2NaHSO4![]() Na2S2O8+H2↑ 3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O Na2S2O8+Cu=Na2SO4+CuSO4 该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用
Na2S2O8+H2↑ 3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O Na2S2O8+Cu=Na2SO4+CuSO4 该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用
【解析】
I.气体B(4.48L)能使湿润的红色石蕊试纸变蓝,B为NH3,其物质的量为4.48L÷22.4L/mol=0.2mol,某物质M (仅含三种元素)是一种储氢材料,M隔绝空气高温分解生成固体A和氨气,镁带在足量气体B中燃烧可生成化合物M,证明M中含有N、H、Mg元素,A只含两种元素,A和水反应生成氨气和白色沉淀C,固体A和水反应生成氨气物质的量为0.1mol,白色沉淀C为氢氧化镁沉淀,则A为Mg3N2,物质的量为0.05mol,由元素守恒可知Mg元素物质的量0.15mol,M中含氮元素为0.2mol+0.1mol=0.3mol,所含氢元素物质的量为(8.4g-0.3mol×14g/mol-0.15mol×24g/mol)÷1g/mol=0.6mol,M中元素物质的量之比为n(Mg):n(N):n(H)=0.15:0.3:0.6=1:2:4,可知M化学式为Mg(NH2)2,以此来解答。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为0.1mol,X与水共热生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,B中含有Na元素,则X含有Na元素,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀,白色沉淀为BaSO4,其物质的量为0.2mol,根据S原子守恒可知X中含有2个S原子,B为NaHSO4,X中三种元素原子个数比为1:1:4,该无机盐X可以表示为(NaSX4)2,则X元素相对原子质量为16,X为O元素,故A为O3,X为Na2S2O8.
Ⅰ. (1)由上述分析可知,M中含元素为Mg、N、H,
故答案为:Mg、N、H;
(2)化合物A与水反应的化学方程式是Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑,
故答案为:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑;
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,气体为氢气,则该反应的化学方程式是Mg+2NH3═Mg(NH2)2+H2↑,
故答案为:Mg+2NH3═Mg(NH2)2+H2↑。
II.(4)单质A为O3,组成元素的简单离子结构示意图为:![]() ,故答案为:
,故答案为:![]() ;
;
(5)X的化学式为:Na2S2O8,故答案为:Na2S2O8;
(6)实验室可通过低温电解NaHSO4溶液制备Na2S2O8,电解方程式为:2NaHSO4![]() Na2S2O8+H2↑;
Na2S2O8+H2↑;
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫.在碱性条件下,Na2S2O8氧化NO的离子方程式为:3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O,
故答案为:3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O;
(8)Na2S2O8与铜反应的化学方程式:Na2S2O8+Cu=Na2SO4+CuSO4,该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用,
故答案为:Na2S2O8+Cu=Na2SO4+CuSO4;该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
①已知KBrO3在反应中得到电子,则该反应的还原剂是____________________
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_____________
③根据上述反应可推知_______
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3
c.还原性:AsH3>X d.还原性:X > AsH3
(2)①向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,该反应常用于检验Mn2+的存在。其特征现象是_________________,若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为__________
②将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+MnSO4+H2SO4→Na2SO4+Bi2(SO4)3+NaMnO4+H2O,配平上述反应的化学方程式,并用双线桥标出电子转移的方向和数目__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
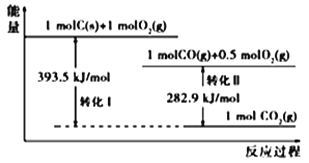
A. 1 molC(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ===2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ===2CO(g) ΔH= 221.2 kJmol1
D. CO的燃烧热ΔH=+282.9 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。

下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
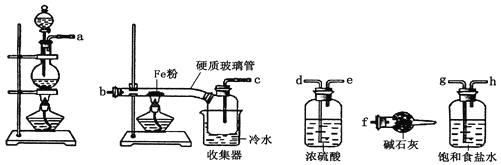
(1) 装置的连接顺序为a→_____→____→____→____→b→c→f。
(2) 硬质玻璃管中可观察到的现象是___________________;硬质玻璃管与收集器之间没有用导管连接,原因是____________________;反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

(3) 试剂X的化学式为___________;有同学分析淡黄色溶液中含有Fe2+,你认为_______(填“合理”或“不合理”);固体产物的成分可能为__________(填相应的字母);
A Fe和FeCl3 B FeCl2和FeCl3 C Fe、FeCl2和FeCl3 D Fe和FeCl2
(4) 加入少许植物油的作用是___________________,用离子方程式表示加入新制氯水后溶液红色加深的原因_______________________________。
(5) 某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因________,请设计实验对你所分析的原因进行验证,简要写出实验方案___________
(6)Cl2是一种黄绿色有刺激性气味的气体,实验室通常用NaOH溶液来吸收Cl2,以减少环境污染。若实验时需要450mL 4mol/L的NaOH溶液,则配制时,需要用托盘天平称取NaOH的质量为_______g,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还必须有_________。配制该溶液时,下列操作会使溶液浓度偏高的是___________。(填字母)
A 称量固体时动作缓慢 B 容量瓶未干燥立即用来配制溶液
C NaOH固体溶解后立刻转移 D 在容量瓶中定容时俯视容量瓶刻度线
E 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此判断:
(1)固体B所含物质的化学式为___________________________________________。
(2)固体E所含物质的化学式为__________________________________。
(3)反应①的离子方程式为________________________________________。
(4)写出向A中加入过量的氢氧化钠的离子方程式________________________________,__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
完成下列填空:
(1)上述反应中的还原剂为___,还原产物有___,当有1molKNO3参加反应时,转移电子的数目为___。
(2)KNO3晶体类型是___,其晶体中存在的化学键有___。
(3)硫原子的核外电子排布式为___,原子核外有___种不同能量的电子。将SO2和Cl2分别通入品红溶液中,产生的现象是___;若将SO2和Cl2等体积混合后再缓缓通入品红溶液,发现品红溶液___,其原因是___。
(4)S、C和N三种元素的原子半径从小到大的顺序是___;K2S溶液中除OH-外其它各离子物质的量浓度的大小顺序为___。
(5)下列事实能说明碳与硫两元素非金属性相对强弱的有___。
a.同温同浓度溶液pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
d.分解温度:CH4>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 代表阿伏加德罗常数的数值,下列说法正确的是
A. 2.4 g 金属镁变成镁离子时失去的电子数目为 0.1NA
B. 18 g 水中含有 0.1NA 个水分子
C. 22.4 L 氮气所含的电子数目为 NA
D. 17 g 氨气所含电子数目为 10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M和乙炔可合成![]() 羟基丁酸,
羟基丁酸,![]() 羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。
羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。

已知:(1).
(2)![]()
(3)
(4)C的结构中不含有甲基
![]() A的结构简式为______,B的分子式______。
A的结构简式为______,B的分子式______。
![]() 反应
反应![]() 的反应类型______。
的反应类型______。
![]() 写出反应
写出反应![]() 化学方程式______。
化学方程式______。
![]() 某烃S是
某烃S是 的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
![]() 理论上A也可以由1,
理论上A也可以由1,![]() 丁二烯与烃F来合成,则F的结构简式为______。
丁二烯与烃F来合成,则F的结构简式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com