
分析 (1)依据配制溶液是在容量瓶中进行,容量瓶的规格需要配制250ml的溶液,再取出230ml溶液;溶液稀释前后溶质物质的量不变计算所需盐酸溶液的体积,根据溶液配制过程和实验步骤分析判断所需要的仪器;
(2)A、容量瓶洗涤后未干燥,不影响溶液配制;
B、移液时,有少量溶液溅出,溶质减少,配制溶液浓度减小;
C、定容时,加水不慎超过刻度线,又倒出一些溶液浓度减小;
D、定容时,俯视刻度线,未加到刻度线,溶液浓度增大;
E、装入试剂瓶时,有少量溶液溅出不影响溶液浓度.
解答 解:(1)依据配制溶液是在容量瓶中进行,容量瓶的规格需要配制250ml的溶液,再取出230ml溶液;溶液稀释前后溶质物质的量不变计算所需盐酸溶液的体积,4mol/L×V=250ml×0.4mol/L,V=25ml;根据溶液配制过程和实验步骤分析判断所需要的玻璃仪器为,溶解所需要的烧杯、玻璃棒和定容所需要的250ml容量瓶,
故答案为:25.0;250mL容量瓶;玻璃棒;
(2)A、容量瓶洗涤后未干燥,不影响溶液配制;
B、移液时,有少量溶液溅出,溶质减少,配制溶液浓度减小;
C、定容时,加水不慎超过刻度线,又倒出一些溶液浓度减小;
D、定容时,俯视刻度线,未加到刻度线,溶液浓度增大;
E、装入试剂瓶时,有少量溶液溅出不影响溶液浓度;
配制过程中导致溶液浓度偏低的操作是BC.
故答案为:BC.
点评 本题考查物质的量浓度计算、一定物质的量浓度溶液配制等,理解溶液配制原理及进行误差分析,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 13种 | C. | 14种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某芳香烃的分子式为C10H14,不能使溴水因反应而褪色,苯环上只有一个取代基,符合条件的烃有4种 | |
| B. | 按照系统命名法,有机物 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、甲酸甲脂都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为 该有机物能发生取代反应 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
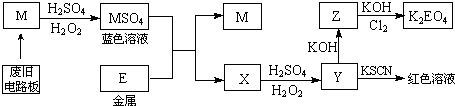
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| V(M)(x10-3mol.L-1.min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | H | HNO |
| 电离常数(25℃) | K=1.8×10-5 | K=4.×10-7 K=5.6×10-11 | K=5.0×10-4 |
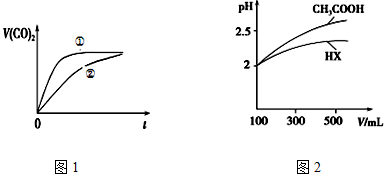
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的氨水溶液中c(OH-)=0.01 mol•L-1 | |
| B. | 常温下,将pH为12的氨水溶液加水稀释100倍,稀释后的溶液pH大于10 | |
| C. | 10 mL 1 mol•L-1的氨水溶液恰好与10 mL 1 mol•L-1的盐酸完全反应 | |
| D. | 在相同条件下,氨水溶液的导电性比NaOH溶液弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14 g丙烯和丁烯的混合气体含有的原子数为6NA | |
| B. | 25℃,pH=1的1 L H2SO4溶液含有的H+数目为0.2NA | |
| C. | 1 mol Fe与一定量的HNO3反应,转移的电子数目一定为3NA | |
| D. | 标准状况下,22.4 L NO和O2的混合气体中所含原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com