


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
| B、Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| C、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D、向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O=Cl-+SO42-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸呈红色的溶液:Na+、NH4+、Cl-、NO3- |
| B、滴入KSCN溶液显血红色的溶液:K+、Na+、CO32-、I- |
| C、能与铝反应产生H2的溶液:K+、Fe2+、Cl-、NO3- |
| D、常温下由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硫酸的电离方程式:H2SO3=2H++SO2-3 | ||
B、中子数为18的氯原子的原子符号:
| ||
| C、(CH3)2CHCH2CH2OH的名称:3-甲基-1-丁醇 | ||
D、HOCH2COOH缩聚产物的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上将烟气中的二氧化硫转化为硫,常用的两种方法分别是热解气还原法和离子膜电解法.
工业上将烟气中的二氧化硫转化为硫,常用的两种方法分别是热解气还原法和离子膜电解法.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )可由下列路线合成:
)可由下列路线合成: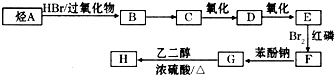
| HBr/过氧化物 |
| Br2/红磷 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com