
下列有关非金属元素说法正确的是
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.液氨汽化时要吸收大量的热,可用作制冷剂
C.硫具有还原性,可用硫粉覆盖地上洒落的汞
D.硅是重要的半导体材料,常用于制作光导纤维
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2016-2017学年内蒙古高二上期中化学卷(解析版) 题型:选择题
在稀氨水溶液中存在如下平衡体系:NH3·H2O NH4+ + OH-,当增大溶液的pH时,c(NH4+)会( )
NH4+ + OH-,当增大溶液的pH时,c(NH4+)会( )
A.可能增大也可能减小 B.增大 C.减小 D.无变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
已知:H2(g)+Br2(g)=2HBr(g) ;△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时 需要吸收的能量/KJ | 436 | a | 369 |
则上述表格中的a值为
A.404 B.344 C.260 D.200
查看答案和解析>>
科目:高中化学 来源:2017届山东省泰安市高三上学期期中化学试卷(解析版) 题型:选择题
某无色稀溶液X中,可能含有如表所列离子中的某几种。
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示。下列说法正确的是

A.若Y是盐酸,则X中一定含有CO32-、SiO32-、[Al(OH)4]-和NH4+
B.若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4
查看答案和解析>>
科目:高中化学 来源:2017届山东省泰安市高三上学期期中化学试卷(解析版) 题型:选择题
中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列 关于:KNO3的古代文献,对其说明不合理的是

查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+ O2(g)═SO2(g)+H2O(g) △H1
O2(g)═SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)═ S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)═S(g)+H2O(g )△H3
O2(g)═S(g)+H2O(g )△H3
2S(g)═S2(g)△H4 则△H4的正确表达式为( )
A. △H4=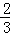 (△H1+△H2﹣3△H3) B. △H4=
(△H1+△H2﹣3△H3) B. △H4=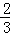 (3△H3﹣△H1﹣△H2)
(3△H3﹣△H1﹣△H2)
C. △H4= (△H1+△H2﹣3△H3) D. △H4=
(△H1+△H2﹣3△H3) D. △H4= (△H1﹣△H2﹣3△H3)
(△H1﹣△H2﹣3△H3)
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:选择题
在体积均为1.0 L的恒容两个密闭容器中分别 加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A.化学平衡常数K:K(状态I) < K(状态II) <K(状态III)
B.CO2的平衡转化率α:α(状态I) <α(状态Ⅱ)=α(状态III)
C.体系中c(CO):c (CO,状态Ⅱ) < 2c (CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)> v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:实验题
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。

A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通 入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:  。
。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学 进行了步骤③的实验。
进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com