
分析 短周期的五种主族元素A、B、C、D、E原子序数依次变小,E为周期表中原子半径最小的元素,则E为H元素;C为自然界含量最多的金属元素,则C为Al元素;D的最外层电子数为次外层的2倍,次外层电子数为2,最外层电子数为4,则D为C元素;B、D属于同一主族,则B为Si元素;A的单质在常温下为气态,A为第三周期的非金属元素,则A为Cl元素,然后利用元素及其单质、化合物的性质来解答.
解答 解:短周期的五种主族元素A、B、C、D、E原子序数依次变小.E为周期表中原子半径最小的元素,则E为H元素;C为自然界含量最多的金属元素,则C为Al;D的最外层电子数为次外层的2倍,次外层电子数为2,最外层电子数为4,则D为C;B、D属于同一主族,则B为Si;A的单质在常温下为气态,A为第三周期的非金属元素,则A为Cl,
(1)由上述推断可知,A为氯,B为硅,
故答案为:氯;硅;
(2)A、D分别为Cl、C元素,非金属性Cl>C,则氢化物稳定性较强的为HCl,
故答案为:HCl;
(3)A为Cl、C为Al,A、C的最高价氧化物对应的水化物分别为高氯酸、氢氧化铝,氢氧化铝与盐酸反应生成氯化铝和水,离子方程方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)根据反应CO2+SiO32-+H2O=H2SiO3+CO32-可知证明碳本比硅酸强,最高价氧化物对应水合物的酸性越强,则非金属性越强,所以碳的非金属性比硅强,
故答案为:CO2+SiO32-+H2O=H2SiO3+CO32-;证明碳本比硅酸强,所以碳的非金属性比硅强.
点评 本题考查原子结构与元素周期律关系,题目难度中等,元素的推断是解答的关键,熟悉元素及其化合物知识即可解答,注意掌握原子结构与元素周期表、元素周期律的关系.


科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.1mol•L-1Na2SO4溶液中,钠离子总数是0.2NA | |
| B. | 常温常压下,32gO2中所含电子的数目为16NA | |
| C. | 1mol Al3+含有电子的数目是3NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E是前四期的元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子有3能级,且有3个未成对电子;D的最外层电子数是内层电子数的3倍.基态的E是前四周期中未成对电子数最多的原子.
有A、B、C、D、E是前四期的元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子有3能级,且有3个未成对电子;D的最外层电子数是内层电子数的3倍.基态的E是前四周期中未成对电子数最多的原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | (CH3)2BrCH2Br | C. | C2H5CHBrCH2Br | D. | CH3(CHBr)2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
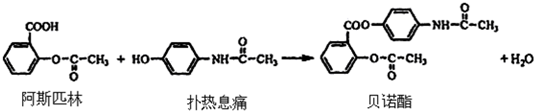
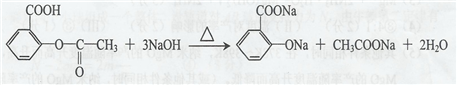 .
.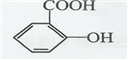 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氟乙烯为非极性分子 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯的分子结构可能为【-CF2-CF2--CF2-CF--CF3-】 | |
| D. | ETFE中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | V1 | 20 |
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明陶瓷材料硒化锌 | B. | 半导体材料砷化镓 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaF | B. | CaO | C. | K2S | D. | MgS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com