
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。
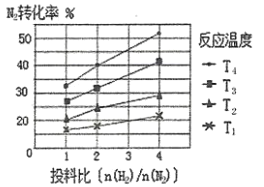
①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
【答案】-92kJ/mol ![]() >
>![]() >
>![]() >
>![]() ABD 0.06mol/(L·min) 12.5
ABD 0.06mol/(L·min) 12.5 ![]() 甲基橙 锥形瓶中溶液颜色的变化 0.0080mol/L或8.0×10-3mol/L 偏大
甲基橙 锥形瓶中溶液颜色的变化 0.0080mol/L或8.0×10-3mol/L 偏大
【解析】
(1)△H=反应物总键能-生成物总键能=![]() =-92kJ/mol
=-92kJ/mol
(2)①合成氨正反应是个放热反应,升高温度不利于氨气生成,所以从氨气转化率可以看出![]() >
>![]() >
>![]() >
>![]() ;
;
②保持温度和体积不变,提高投料比[n(H2)/n(N2)],相当于增大氢气浓度,平衡向正反应方向进行,提高氮气的转化率,但自身的转化率会降低,由于体积不变,因此重新达到平衡时氢气的浓度也一定增大,氮气的浓度会降低,由于气体的物质的量也增加,因此平衡时氨气的体积分数不一定增大,答案选ABD;
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,
,若5min后反应达到平衡,![]() 转化率为20%,反应在
转化率为20%,反应在![]() 时
时
![]()
起始浓度(mol/L) 0.50.5 0
变化浓度(mol/L) 0.1 0.3 0.2
平衡浓度(mol/L) 0.40.2 0.2
则v(![]() )=
)=![]() =0.06mol/(L·min),平衡常数K=
=0.06mol/(L·min),平衡常数K=![]() =12.5;
=12.5;
(3)一种新型除烟气中氮氧化物的方法是采用NH3作还原剂还原烟气中的氮氧化物且产物无污染,因此生成物是氮气和水,则反应的化学反应方程为![]() ;
;
![]() =0.008mol/l;若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,气泡占用实际体积,使体积读数偏大,则测定结果偏大。
=0.008mol/l;若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,气泡占用实际体积,使体积读数偏大,则测定结果偏大。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】化合物![]() (x)、
(x)、![]() (y)、
(y)、![]() (z)的分子式均为C5H6。下列说法正确的是
(z)的分子式均为C5H6。下列说法正确的是
A.x、y、z均能使酸性高锰酸钾溶液褪色
B.z的同分异构体只有x和y两种
C.z的一氯代物只有一种,二氯代物只有两种(不考虑立体异构)
D.x分子中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuSO4溶液。
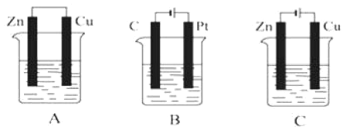
(1)A、B、C三个装置中属于原电池的是___(填字母,下同),属于电解池的是___。
(2)A池中Cu电极上发生的是___(填“氧化”或“还原”)反应。
(3)B池中C是___极,Pt极发生的反应的电极反应式为___。
(4)C池反应过程中,CuSO4溶液的物质的量浓度___(填“变大”“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计方案都正确的是( )
A.制备绿矾(FeSO47H2O):将FeSO4溶液在空气中低温蒸发即得绿矾
B.将0.1000mol/L的KMnO4溶液装在碱式滴定管中滴定未知浓度的过氧化氢溶液,读出消耗的高锰酸钾的体积即可求出过氧化氢的浓度
C.探究催化剂对H2O2分解速率影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象
D.用一定浓度的盐酸标准液滴定未知浓度的氨水,可选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的pH与氢氧化钠溶液体积V的关系如图所示。下列说法不正确的是( )
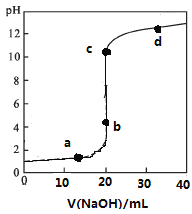
A.可选酚酞或甲基橙作指示剂
B.滴定前HR溶液中存在大量HR分子
C.V=20mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2
D.c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1) 图1是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为______________。
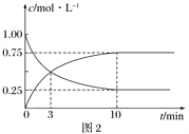
③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2) 在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________________。
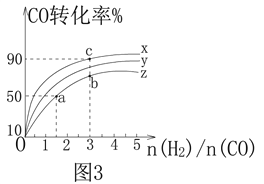
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在室温下可能大量共存的是( )
A.pH=2的溶液:HCO3-、Na+、ClO-、NO3-
B.![]() =106的溶液:Al3+、NH4+、CO32-、S2-
=106的溶液:Al3+、NH4+、CO32-、S2-
C.水电离出的c(H+)=10-4mol/L的溶液:Na+、Fe3+、SO42-、Cl-
D.使石蕊呈红色的溶液:NH4+、NO3-、AlO2-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列说法正确的是![]()
A.![]() 醋酸溶液中加入冰醋酸,电离平衡正向移动,醋酸的电离程度增大
醋酸溶液中加入冰醋酸,电离平衡正向移动,醋酸的电离程度增大
B.![]() 时,
时,![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,
的醋酸溶液等体积混合,![]()
C.![]() 溶液和
溶液和![]() 溶液分别加热蒸干并灼烧,最终都能得到
溶液分别加热蒸干并灼烧,最终都能得到![]()
D.酸碱中和滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中液面变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com