
下列元素性质的递变规律正确的是()
A. 原子半径:Be<B<C<N
B. 第一电离能:B<Be<Mg<Na
C. 元素的电负性:O>N>S>P
D. 气态氢化物的稳定性:NH3<CH4<PH3<SiH4
考点: 元素周期律的作用.
专题: 元素周期律与元素周期表专题.
分析: A、同一周期元素原子半径从左到右逐渐减小;
B、同一主族元素的第一电离能从上到下逐渐减小,同周期第ⅡA族大于第ⅢA族;
C、同一周期元素从左到右电负性逐渐增大,同一主族元素从上到下电负性逐渐减小;
D、元素非金属性越强,其气态氢化物的稳定性越强.
解答: 解:A、同一周期元素原子半径从左到右逐渐减小,因此原子半径Be>B>C>N,故A错误;
B、同一主族元素的第一电离能从上到下逐渐减小,第一电离能:Be>Mg>Na,故B错误.
C、同一周期元素从左到右电负性逐渐增大,因此O>N、S>P,同一主族元素从上到下电负性逐渐减小,因此O>S、N>P,所以电负性:O>N>S>P,一般来说,元素非金属性越强电负性越小,故C正确;
D、元素非金属性越强,其气态氢化物的稳定性越强,非金属性:N>P,C>Si,则气态氢化物的稳定性:NH3>CH4,NH3>PH3,CH4>SiH4,故D错误.
故选:C.
点评: 本题考查了元素周期律的应用,为2015届高考常见题型,难度不大,可根据元素周期律的有关知识进行解答,注意基础知识的积累.


科目:高中化学 来源: 题型:
某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
②在下面的化学式上标出电子转移的方向和数目KMnO4+KI+H2SO4→
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组.原因是 . .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验处理不可行的是( )
①将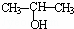 与NaOH的醇溶液共热制备CH3﹣CH═CH2
与NaOH的醇溶液共热制备CH3﹣CH═CH2
②向甲酸(H﹣COOH)和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,检验混合物中是否含有甲醛
③向丙烯醛(CH2=CH﹣CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
④为验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再滴入几滴硝酸银溶液,观察现象.
|
| A. | 只有①③ | B. | 只有①②④ | C. | 只有②③④ | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. SiH4比CH4稳定
B. O2﹣半径比F﹣的小
C. Na和Cs属于第 IA族元素,Cs失电子能力比Na强
D. P和As属于第 VA族元素,H3PO4酸性比H3AsO4弱
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利原理③,哪些违反了洪特规则④.
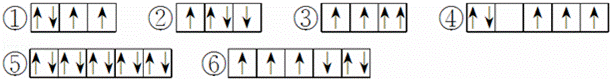
(2)某元素的激发态(不稳定状态)原子的电子排布式为 ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应水化物的化学式是 .
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列 .
①2s②3d③4s④3s⑤4p⑥3p.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
配制物质的量浓度的溶液,造成浓度偏高的操作是()
A. 定容时,滴加蒸馏水超过刻度线
B. 定容时,眼睛俯视刻度线
C. 洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D. 定容时,眼睛仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液含有Na+、Ba2+、Cu2+、HCO3﹣、SO42﹣、Cl﹣等离子中的若干种.依次进行下列实验,现象如下:
①取少量溶液于试管之中,滴入几滴紫色石蕊试液后溶液显红色;
②另取少量的原溶液,先加入过量的NaOH溶液,然后再滴加适量的Na2CO3溶液,产生白色沉淀.
请回答下列问题:
(1)原溶液中肯定存在的离子有 ;
原溶液中肯定不存在的阳离子有 ,
(3)写出②中发生反应的离子方程式: ; .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com