
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:C=1:2 | D:E=1:3 | B:E=1:4 |
 ,丁的结构式
,丁的结构式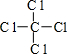
 .
.分析 原子序数依次增大的A、B、C、D、E五种短周期元素,B原子最外层电子数比其次外层电子数多两个,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,原子序数小于碳,只能处于第一周期,可推知A为H元素;D和E位于同一周期,且D和E的原子序数之和为30,则二者处于第三周期,为Al与Cl或Si与S,且B、E形成的化合物丁在B:E=1:4,则D为Al、E为Cl;C是E的邻族元素,化学性质活泼,C的原子序数小于铝,则C为氧元素,可推知甲为H2O2,乙为CO2,丙为AlCl3,丁为CCl4,据此进行解答.
解答 解:原子序数依次增大的A、B、C、D、E五种短周期元素,B原子最外层电子数比其次外层电子数多两个,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,原子序数小于碳,只能处于第一周期,可推知A为H元素;D和E位于同一周期,且D和E的原子序数之和为30,则二者处于第三周期,为Al与Cl或Si与S,且B、E形成的化合物丁在B:E=1:4,则D为Al、E为Cl;C是E的邻族元素,化学性质活泼,C的原子序数小于铝,则C为氧元素,可推知甲为H2O2,乙为CO2,丙为AlCl3,丁为CCl4,
(1)由上面的分析可知,甲为H2O2,电子式为 ;丁为CCl4,其结构式为:
;丁为CCl4,其结构式为: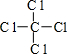 ,
,
故答案为: ;
;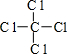 ;
;
(2)E为氯元素,位于周期表中第三周期ⅦA族,其最简单离子为氯离子,核电荷数为17,最外层导电8电子稳定结构,其离子结构示意图为: ,
,
故答案为:第三周期ⅦA族; ;
;
(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是Al,反应的离子方程式为:2Al+6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al;2Al+6H+=2Al3++3H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,侧重对化学用语的考查,正确推断元素为解题关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有单质参加的化合反应一定不属于氧化还原反应 | |
| B. | 离子反应一定属于氧化还原反应 | |
| C. | 有的复分解反应属于氧化还原反应 | |
| D. | 置换反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和Ba(NO3)2的混合溶液 | B. | BaCl2溶液 | ||
| C. | NaOH溶液 | D. | 澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl | B. | (CH3)3CBr | C. | (CH3)3CCH2Cl | D. | (CH3)2CBrCH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
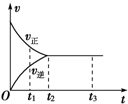
| A. | t1时,只有正方向反应 | B. | 0~t1,c(Z)在减小 | ||
| C. | t2~t3,反应不再进行 | D. | t2~t3,各物质的浓度不再发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com