


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| 温度(℃) | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度(g/100g水) | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.3 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||||
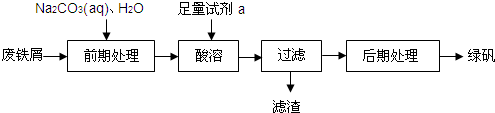


查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作及现象 | 溶液 |
| A | 向溶液中加入KSCN溶液,观察无明显现象,继续加入氯水,溶液变红色 | 含有Fe2+溶液 |
| B | 向溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 含有CO32-溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. | 可能为Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊. | 可能为Ca(OH)2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
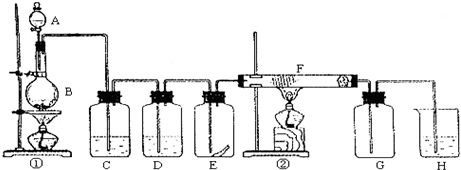
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定存在SO32-离子 |
| B、一定存在CO32-离子 |
| C、一定存在Cl-离子 |
| D、可能存在HCO3-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 ,核磁共振氢谱显示只有一种化学环境的氢原子,则该烃的结构简式为
,核磁共振氢谱显示只有一种化学环境的氢原子,则该烃的结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com