
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( S-32 O-16 ) ( )
A.标准状况下,22.4L氦气含有2NA个氦原子
B.在常温常压下,11.2L Cl2含有的分子数为0.5NA
C.常温常压下,64g SO2中含有的氧原子数为2NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】关于铁及其化合物的叙述正确的是( )
A.铁是一种较活泼的金属
B.Fe2O3在常温下可以导电
C.Fe2O3溶于水生成Fe(OH)3
D.在常温下铁丝容易与水反应放出H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯可与金属Fe、盐酸反应生成苯胺和FeCl2,反应如下:
![]() +3Fe+6HCl
+3Fe+6HCl![]()
![]() +3FeCl2+2H2O
+3FeCl2+2H2O
(1)写出Fe2+基态核外电子排布式:_______。
(2)苯胺分子中C、N原子的杂化方式分别是________。1mol苯胺分子中含σ键的数目是___。
(3)苯胺与盐酸反应可生成氯化苯胺盐![]() ,氯化苯胺盐中含有的化学键有______。
,氯化苯胺盐中含有的化学键有______。
(4)苯胺在水中的溶解度大于硝基苯,其原因是________。
(5)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则两种晶胞中Fe原子的配位数之比为_______。
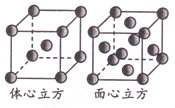
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5.1g镁铝合金投入500mL 2 mol/L盐酸溶液中,金属全部溶解后,再加入4 mol/L NaOH溶液,若要达到沉淀最大值,则加入NaOH溶液的体积应为( )
A. 560mL B. 425mL C. 500mL D. 250mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制480 mL 0.1 mol/L CuSO4溶液,需要称量CuSO4·5H2O ________g。
(2)取200 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到29.02 g白色沉淀,用过量稀盐酸处理后沉淀量减少到9.32 g,并有气体放出。原混合溶液中Na2SO4的物质的量浓度为________mol·L-1;产生的气体在标准状况下的体积为________L。
(3)在实验室将8.4g固体NaHCO3加热一段时间后,测得剩余固体的质量变为6.85g.则有______ g NaHCO3固体发生了分解反应。若继续对剩余固体加热,至不再产生气体后,将冷却后的固体溶解于水,配成1000mL的溶液.则该溶液溶质的物质的量浓度是____________。
(4)向VL AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值,继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)将ClO2 列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛的应用.ClO2属于( )
A.酸
B.碱
C.氯化物
D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是学习和研究化学的一种重要方法。下列分类不合理的是( )
A.CaO和SO3都属于氧化物
B.K2SO4和KHCO3都属于盐
C.KOH和Na2CO3都属于碱
D.H2SO4和H3PO4都属于酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
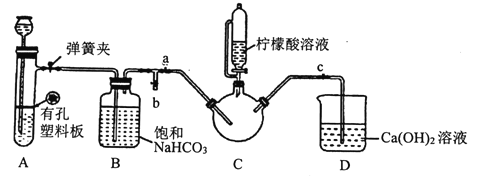
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是________________________________。
(2)停止反应,待装置冷却后,取出反应后的混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中含有Fe3+的操作方法:______________________________。
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得的产物中不含+3价的铁,原因是(结合化学方程式说明)___________________。
(4)向上述滤液中加入NaOH 溶液后,观察到的现象为_______________________。沉淀由白色变为红褐色的原因是______________________________________(用化学方程式表示)
(5)为了得到白色的Fe(OH)2沉淀,并尽可能可能较长时间保持白色沉淀,该同学设计了如图所示的装置,请简述实验操作:______________________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com