
【题目】过碳酸钠(2Na2CO33H2O2)是由Na2CO3与H2O2复合而形成的一种固体放氧剂,同时具有Na2CO3和H2O2双重性质。可用于洗涤、纺织、医药、卫生等领域.工业上常以过碳酸钠产品中活性氧含量([O]%= ![]() ×100来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如图:
×100来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如图:
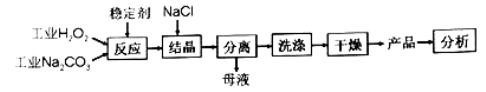
回答下列问题:
(1)过碳酸钠受热易分解,写出反应的化学方程式_____________________.
(2)稳定剂及反应温度等因素对产品质量有很大影响.
①下列试剂中,可能用作“稳定剂”的是__________(填字母).
a.MnO2 b.KI c.Na2SiO3 d.FeCl3
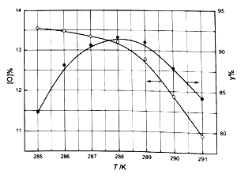
②反应温度对产品产率(y%)及活性氧含量的影响如下图所示.要使产品达到优等品且产率超过90%合适的反应温度范围是_______________.
③“结晶”时加入NaCl的目的是____________ .
(3)“母液”中可循环利用的主要物质是____________________.
(4)产品中活性氧含量的测定方法:称量0.1600g样品,在250mL锥形瓶中用100mL 0.5molL-1硫酸溶解完全,立即用0.02000molL-1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMn04溶液的平均体积为2.24mL.
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有_______________.
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响 (填“偏大”、“偏小”或“不变”)及其原因____________.
③该样品的活性氧含量为__________% 。
【答案】
(1)2(2Na2CO33H2O2 )![]() 4Na2CO3+3O2↑+6H2O;
4Na2CO3+3O2↑+6H2O;
(2)①c;②286.8~288.5K;③提高产量;增加钠离子浓度,促进过碳酸钠析出;
(3)NaCl
(4)①H2O2、CO2;②偏低,工业盐酸常含微量Fe3+,溶解过程会催化H2O2分解;③12.16%
【解析】
试题分析:(1)过碳酸钠(2Na2CO33H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂,受热分解生成碳酸钠、氧气、水,反应为:2(2Na2CO33H2O2 )![]() 4Na2CO3+3O2↑+6H2O,故答案为:2(2Na2CO33H2O2 )
4Na2CO3+3O2↑+6H2O,故答案为:2(2Na2CO33H2O2 )![]() 4Na2CO3+3O2↑+6H2O;
4Na2CO3+3O2↑+6H2O;
(2)①过碳酸钠(2Na2CO33H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂,具有碳酸钠和过氧化氢的性质,过氧化氢易分解,MnO2、FeCl3为其催化剂,所以不能选,过氧化氢与碘离子发生氧化还原反应:2I-+H2O2+2H+=I2+2H2O,所以也不能选,过碳酸钠与硅酸钠不反应,可能用作“稳定剂”,故C选项符合,故答案为:c;
②根据图象分析,温度为286.8~288.5K,产品达到优等品且产率超过90%,超过288.5K后,活性氧百分含量和产率均降低,所以最佳反应温度范围为286.8~288.5K,故答案为:286.8~288.5K;
③结晶过程中加入氯化钠、搅拌,增加钠离子浓度,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,故答案为:提高产量;增加钠离子浓度,促进过碳酸钠析出;
(3)结晶过程中加入氯化钠促进过碳酸钠析出,“母液”中主要为氯化钠溶液,NaCl溶液又是结晶过程中促进过碳酸钠析出的原料,故循环利用的物质是NaCl,故答案为:NaCl;
(4)①过碳酸钠(2Na2CO33H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂,过碳酸钠与硫酸反应,为碳酸钠、过氧化氢和硫酸反应,所以产物为硫酸钠、过氧化氢、二氧化碳、水,故答案为:H2O2、CO2;
②Fe3+为过氧化氢分解的催化剂,工业盐酸常含微量Fe3+,溶解过程会催化H2O2分解,测定时,若用工业盐酸代替硫酸,分析对测定结果偏低,故答案为:偏低,工业盐酸常含微量Fe3+,溶解过程会催化H2O2分解;
③称量0.1600g样品,在250mL锥形瓶中用100mL 0.5molL-1硫酸溶解完全,立即用0.02000molL-1高锰酸钾标准溶液滴定,反应中MnO4-是氧化剂,H2O2是还原剂,氧化产物是O2;依据元素化合价变化,锰元素化合价从+7价变化为+2价,过氧化氢中的氧元素化合价从-1价变化为0价,根据电子守恒配平写出离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2三次滴定平均消耗KMnO4溶液26.56mL,依据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;
2MnO4- ~ ~ ~ ~ ~ 5H2O2;
2 5
(0.2526-0.0224)L×0.02mol/L 0.01216mol
过碳酸钠产品中活性氧含量([O]%=![]() ×100%=
×100%=![]() =12.16%,故答案为:12.16。
=12.16%,故答案为:12.16。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】如图是在法国拍卖会拍卖的我国圆明园兽首﹣﹣兔首和鼠首,拍卖台上渴望回家的铜器兔首和鼠首看上去仍熠熠生辉.下列对其原因的分析,最可能的是( )

A.它们的表面都电镀上了一层耐腐蚀的黄金
B.环境污染日趋严重,它们表面的铜绿被酸雨溶液洗去
C.铜的活动性比氢弱,因此不易被氧化
D.它们是含一定比例金、银、锡、锌的铜合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
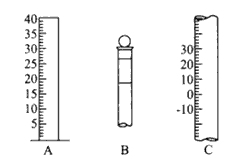
I、如下图所示为常见仪器的部分结构。请写出下列仪器名称:A___________,B___________,C____________
II、下图为实验装置。
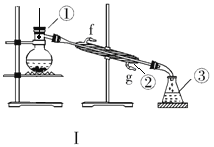
(1)写出下列仪器的名称:①__________②_____________③____________;
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有____________________,将仪器补充完整后进行的实验操作的名称为_____________________。
III、下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计 ②容量瓶 ③玻璃棒 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦分液漏斗
(1)在仪器上标明具体使用温度的是(不考虑温度计)_____________ _____(填写编号);可作反应容器并可加热的是__________________(填编号);使用时必须检查是否漏水__________________。(填序号)
(2)下列需要用温度计的实验是_________________(填写编号)。
①蒸馏法回收碘的CCl4溶液中的CCl4 ②浓硫酸稀释 ③测定硝酸钾的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为原料合成重要精细化工中间体TMBA( )和抗癫痫药物H(
)和抗癫痫药物H( )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):

已知:I.RONa+R′X→ROR′+NaX;
II.![]() (R、R′表示烃基或氢)
(R、R′表示烃基或氢)
(1)A的名称是 ;C能发生银镜反应,则C分子中含氧官能团的名称是 .
(2)①和②的反应类型分别是 、 .
(3)E的结构简式是 ,试剂a的分子式是 .
(4)C→D的化学方程式是 .
(5)D的同分异构体有多种,其中属于芳香族酯类化合物的共有 种.
(6)F与新制Cu(OH)2悬浊液发生反应的化学方程式是 .
(7)已知酰胺键(![]() )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 .
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.在100 mL浓度为1 molL﹣1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+
B.在100 mL浓度为2 molL﹣1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I﹣+5Cl2═4Fe3++3I2+10Cl﹣
C.向NaHCO3溶液中加入过量的澄清石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+CO32﹣
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是( )
A.甲=丙>乙 B.丙>乙>甲 C.乙>甲=丙 D.甲=乙=丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物
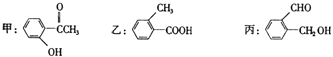
(1)请写出丙中含氧官能团的名称: .
(2)请判别上述哪些化合物互为同分异构体: .
(3)现有甲、乙、丙三种化合物,请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可).
鉴别甲的方法: .
鉴别乙的方法: .
鉴别丙的方法: .
(4)请按酸性由强至弱排列甲、乙、丙的顺序: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯(C2H4)和乙烷(C2H6)的混合气体共amol,与bmolO2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45gH2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)= 。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的2/3时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
(3)a的取值范围是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com