
(7分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g)。2 min时生成0.3 mol W,此时测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 mol·L-1·min-1。
(2)计算n值和2 min末时Y的浓度(写出必要的计算过程)。
(1)0.05 (2)4;0.175 mol·L-1
解析试题分析: 4X(g)+5Y(g)===nZ(g)+6W(g)
起始量/mol 0.4 0.6 0 0
转化量/mol 0.2 0.25 0.05n 0.3
2 min末/mol 0.2 0.35 0.05n 0.3
(1)X的浓度变化量是0.2mol÷2L=0.1mol/L,则前2 min内用X的浓度变化表示的平均反应速率为0.1mol/L÷2min=0.05mol·L-1·min-1。
(2)Δc(Z)="0.05n" mol/2L ="0.025n" mol·L-1
v(Z)=Δc/Δt="0.025n" mol·L-1÷2min =0.05mol·L-1·min-1
解得n=4
2min末时Y的浓度为="0.35mol/2L=0.175" mol·L-1
考点:考查可逆反应的有关计算


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
根据反应:mA(g) + nB(g) pC(g) △H,结合图中所给的信息填空。
pC(g) △H,结合图中所给的信息填空。
(填“>”、“=”或“<”)
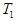 ______
______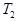
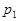 ______
______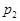
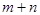 ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【化学与技术】
工业上以氨气为原料制备硝酸的过程如图1所示:
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是 ;
(2)连接好装置后,首先进行的操作是 ;
(3)通入a气体的目的是 ;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是 。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是 ;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
| A.减少NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
 N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(12分)在一容积为2L的密闭容器中加入2molA和6molB,保持温度为20℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)  2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
⑴求20℃时,该反应的平衡常数K(保留三位有效数字)
⑵20℃时,若在同一容器中加入1molA、 mol B和 mol C,则平衡混合气中C的体积分数仍为ω。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在体积固定的密闭容器中N2与H2发生反应:N2(g)+3 H2 2 NH3
2 NH3
达到平衡时c (N2)=3.5 mol·L-1,c (H2)=1 mol·L-1,c (NH3)=5 mol·L-1,求:
(1)N2和H2的起始浓度(4分)
(2)N2的转化率(2分)(要求有解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:
2X(气)+Y(气)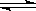 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为 ;平衡时,气体的总物质的量是 。
(2)若向密闭器中通入X(气)和Y(气)的物质的量分别记为n(X)、n(Y),保持容器容积不变,并满足平衡时Z的体积分数为0.4,则n(X)/n(Y)的取值范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业制硫酸时,利用催化氧化反应将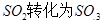 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下,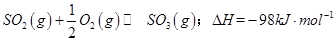 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol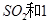 mol
mol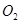 ,发生反应:
,发生反应: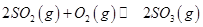 ,达平衡后改变下述条件,
,达平衡后改变下述条件,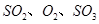 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol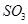 |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol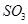 |
| D.移动活塞压缩气体 |
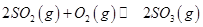 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。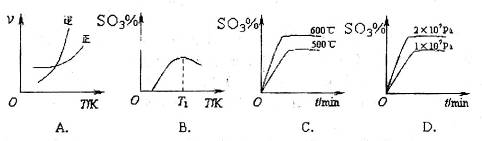
 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始 pH | 废水样品 体积/mL | 草酸溶液 体积/mL | 蒸馏水 体积/mL |
| ① | 4 | | 10 | 30 |
| ② | 5 | 60 | 10 | |
| ③ | | 60 | | 20 |
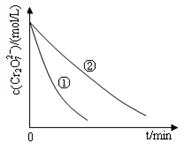
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com