


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、盛放氢氧化钠溶液的试剂瓶不能用玻璃塞 |
| B、氯气,浓氯和氯水是同一种物质 |
| C、从海水中提取溴,一般要经历浓缩,氧化和提取三个步骤,氧化剂一般选择氯气 |
| D、向盛有碘水的试管中加入适量CCl4,振荡静置,溶液分层,上层无色下层紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
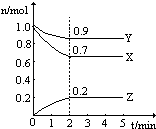 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ||
| B | C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管A中,滴加2mol?L-1HCl至溶液呈酸性,加入几滴 | 证明待测液中含SO32-. |
| 步骤② | 有白色沉淀生成, 证明待测液中含SO42-. | |
| 步骤③ | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Al2(SO4)3=Al3++S
| ||
B、H2SO2═2H++S
| ||
| C、Ba(OH)2=Ba2++(OH-)2 | ||
D、KOH=K++
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com