
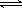 H++HCO3- Ka1 =4.45×10-7
H++HCO3- Ka1 =4.45×10-7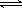 H++CO32- Ka2=5.61×10-11
H++CO32- Ka2=5.61×10-11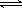 H++ClO- Ka=2.95×10-8
H++ClO- Ka=2.95×10-8科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
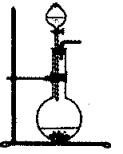
| 所制气体 | 药品 | |
| 分液漏斗内 | 烧瓶中 | |
| O2 | | MnO2 |
| H2 | 稀H2SO4 | |
| Cl2 | 浓HCl | MnO2 |
| SO2 | 浓H2SO4 | Na2SO3 |
| CO2 | 稀H2SO4 | 石灰石 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
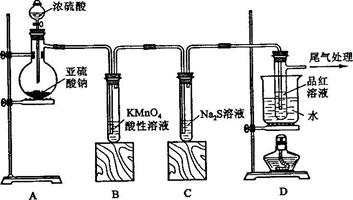
 应的化学方程式为 ;
应的化学方程式为 ; 溶液吸收。
溶液吸收。查看答案和解析>>
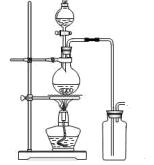
科目:高中化学 来源:不详 题型:实验题
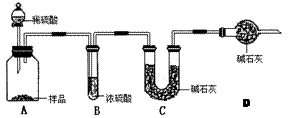
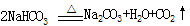 。请回答:
。请回答:| 分析与计算 分组 | 计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 | | 失 败 | |
| 乙 | |  成 功 成 功 | |
| 丙 | |  成 功 成 功 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
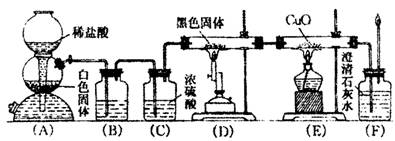

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com