
| A. | 溶液中水电离出的c(H+)=10-10 mol•L-1 | |
| B. | 溶液中c(H+)+c(A-)=0.1 mol•L-1 | |
| C. | 与0.05 mol•L-1 NaOH溶液等体积混合,水的电离平衡向正向移动 | |
| D. | 上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大 |
分析 常温下0.1mol/L某一元酸(HA)溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10,c(H+)×c(OH-)=10-14可知,溶液中c(OH-)2=10-24,则c(OH-)=10-12,则c(H+)=0.01mol/L,则HA为弱酸;
A、溶液中水电离出的c(H+)水=c(OH-)水;
B、根据物料守恒分析;
C、0.1mol/L某一元酸(HA)浓度与0.05mol/LNaOH溶液等体积混合生成0.025mol•L-1的HA和0.025mol•L-1的NaA;
D、HA溶液中加入一定量NaA晶体会抑制HA电离,加水稀释氢离子浓度减小.
解答 解:常温下0.1mol/L某一元酸(HA)溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10,c(H+)×c(OH-)=10-14可知,溶液中c(OH-)2=10-24,则c(OH-)=10-12,则c(H+)=0.01mol/L,则HA为弱酸;
A、溶液中c(H+)=0.01mol/L,则c(OH-)=10-12mol/L,该溶液中由水电离出的c(H+)=c(OH-)=10-12mol/L,故A错误;
B、0.1mol/L某一元酸(HA)溶液中A元素的总物质的量为0.1mol/L,则c(HA)+c(A-)=0.1mol/L,故B错误;
C、0.1mol/L某一元酸(HA)浓度与0.05mol/LNaOH溶液等体积混合生成0.025mol•L-1的HA和0.025mol•L-1的NaA,HA浓度减小,对水的电离的抑制作用减弱,水的电离平衡向正向移动,故C正确;
D、HA溶液中加入一定量NaA晶体,A-离子浓度增大,抑制HA电离,氢离子浓度减小,则氢氧根离子浓度增大,加水稀释会促进酸的电离,但是溶液体积增大的程度大于氢离子物质的量增大的程度,所以氢离子浓度减小,则氢氧根离子浓度增大,故D正确;
故选CD.
点评 本题考查弱电解质在溶液中的电离,题目难度中等,本题的关键是根据溶液中c(H+)与c(OH-)的比值,结合溶液的离子积常数Kw计算出溶液的c(H+),判断出HA为弱酸.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
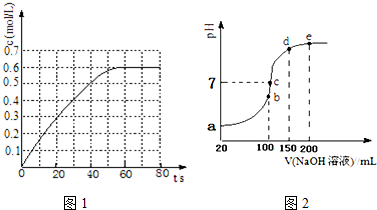
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
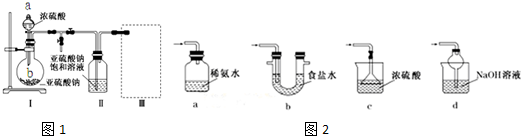
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
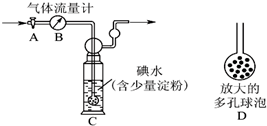 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+H2(g)?CH3CH2CH2CH3(g)△H1
(g)+H2(g)?CH3CH2CH2CH3(g)△H1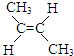 (g)+H2(g)?CH3CH2CH2CH3(g)△H2
(g)+H2(g)?CH3CH2CH2CH3(g)△H2| 温度(℃) | 300 | 320 | 340 |
| K1 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| K2 | 8.4×105 | 3.5×103 | 1.6×103 |
 (g)→
(g)→ (g)△H
(g)△H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com