
C、N、Na、Cu、O、Si、S、Cl是常见的八种元素。
(1)S在元素周期表的位置是_________________;Cl?的离子结构示意图是__________;Na2O2的电子式____________。
(2)用“>”或“<”填空:
非金属性 | 离子半径 | 热稳定性 | 酸性 |
N____Cl | S2-__Na+ | NH3____H2O | H2SO4__HClO |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1.5mol CuCl(s),放热66.6 kJ,该反应的热化学方程式是_____________________。
(4)气体分子(CN)2的结构式为__________,(CN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为______________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年广东深圳高级中学高一上期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.100 mL3 mol·L-1的硫酸与100 mL H2O混合,硫酸物质的量浓度变为1.5 mol·L-1
B.把100 g 20%的NaCl溶液与100 g H2O混合后,NaCl溶液的质量分数是10%
C.把200 mL3 mol·L-1的BaCl2溶液与100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D.把100 mL 20%的NaOH溶液与100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附中高考适应性月考(四)理综化学试卷(解析版) 题型:填空题
图是某课题组设计的合成聚酯类高分子材料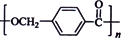 的路线:
的路线:
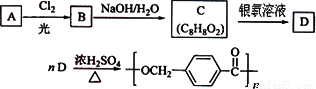
已知:①烃A的相对分子质量为106;
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮: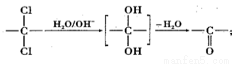
③C可发生银镜反应。
请根据以上信息回答下列问题:
(1)A的结构简式为______________________。
(2)由A生成B的反应类型是________;由C生成D的反应类型是________。
(3)由B生成C的化学方程式为________________________________________________________,该反应过程中生成的不稳定中间体的结构简式应是________________________________________。
(4)D的分子式为________;D的同分异构体中,满足下列条件的有______________种。
①仅含有苯环,无其他环状结构;
②遇三氯化铁溶液显紫色;
③1mol能与3mol金属钠反应生成1.5mol氢气。
其中核磁共振氢谱表明分子中有四种氢,且其峰面积之比为3:2:2:1,请写出其结构简式:________。
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.向氯化铁溶液中加入氢氧化镁:3Mg(OH)2(s)+2Fe3+(aq)=2Fe(OH)3(s)+3Mg2+(aq)
B.钠与硫酸铜溶液反应:2Na+Cu2+=Cu+2Na+
C.已知:酸的强弱H2CO3>HClO>HCO3-,则:2ClO-+CO2(少量)+H2O=CO32-+2HClO
D.将足量的碳酸氢钠溶液加入少量澄清石灰水中:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第五次月考理化学试卷(解析版) 题型:选择题
下列说法正确的是
A.已知C2H6的燃烧热为1090 kJ·mol-1,则C2H6燃烧的热化学方程式为:
C2H6(g)+3.5O2(g)===2CO2(g)+3H2O(g) ΔH=-1090 kJ/mol
B.已知2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热
ΔH=-283 kJ
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古巴彦淖尔市高三上期中考试理化学试卷(解析版) 题型:填空题
立方烷(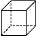 )具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
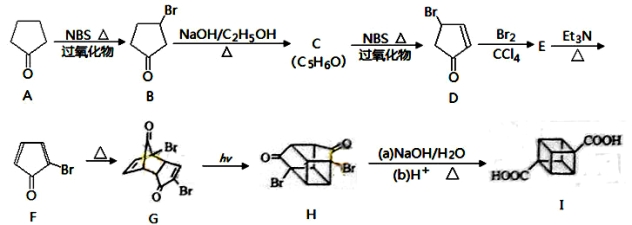
回答下列问题:
(1)C的结构简式为 ,E的结构简式为 。
(2)③的反应类型为 ,⑤的反应类型为 。
(3)化合物A可由环戊烷经三步反应合成:
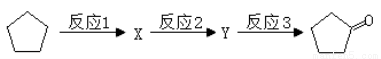
反应1的试剂与条件为 ;反应2的化学方程式为 ;
反应3可用的试剂为 。
(4)在I的合成路线中,互为同分异构体的化合物是 (填化合物代号)。
(5)I与碱石灰共热可转化为立方烷,立方烷的核磁共振氢谱中有 个峰。
(6)立方烷经消化可得到六硝基立方烷,其可能的结构有 种。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:填空题
I:工业制硫酸时,利用接触氧化反应将SO 2转化为SO 3是一个关键步骤 。
(1)某温度下,2SO 2(g)+O 2(g) 2SO 3(g) △H=-197 kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
2SO 3(g) △H=-197 kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是______(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
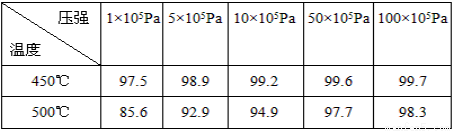
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。
2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。
(4)能判断该反应达到平衡状态的依据是___________。
A. 容器的压强不变
B. 混合气体的密度不变
C. 混合气体中SO 3的浓度不变
D. C(SO 2)=C(SO 3)
E. v 正(SO 2)=v 正(SO 3)
F. v 正(SO 3)=2v 逆(O 2)
II:研究化学反应原理对于生产生活是很有意义的。
(1)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(2)若在0.1mol·L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南二校高一理科实验班上联考2化学卷(解析版) 题型:选择题
NaCl溶液中可能混有杂质NaOH、NaHCO3、Na2CO3中的一种或二种,为测定溶液中混有的杂质成分,可进行如下实验操作:分别取二份等体积混合液,用盐酸的标准液 (0.10 mol/L)滴定,以酚酞或甲基橙为指示剂,达到终点时消耗盐酸的体积分别为V1和V2,且V2>V1。则NaCl溶液中混有的杂质可能为( )
A.NaOH B.Na2CO3 C.Na2CO3、NaHCO3 D.NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高一上12月月考化学卷(解析版) 题型:选择题
若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是
A.Fe3+、NO3﹣、Cl﹣、Na+ B.Ba2+、Mg2+、HCO3﹣、AlO2﹣
C.NO3﹣、Na+、K+、CO32﹣ D.NO3﹣、K+、AlO2﹣、OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com