
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是 ;Y与过量浓硝酸反应后溶液中含有的盐的化学式为 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下: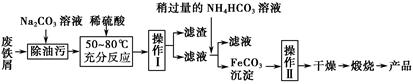
回答下列问题:
①操作Ⅰ的名称是 ;操作Ⅱ的名称是 ;操作Ⅱ的方法为 。
②请写出生成FeCO3沉淀的离子方程式: 。
科目:高中化学 来源: 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示: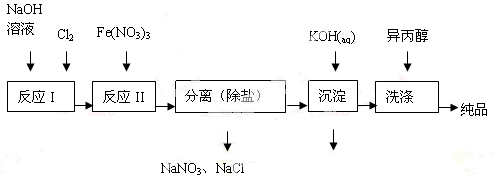
①洗涤粗品时选用异丙醇而不用水的理由是 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
历史上金、银、铜主要是作为货币金属或装饰品被应用。
(1)金、银、铜常被作为钱币流通,从化学角度来看,主要是利用它们的 。
A.硬度适中
B.密度适中
C.在自然界里都可得到纯净的单质
D.不活泼性
(2)一位收藏者有一枚表面是黑色,且有少量绿色锈状物的货币,这肯定是 币,黑色物质是 ,形成这种物质的化学方程式为 ,绿色物质是 ,形成这种物质的化学方程式为 ,这枚金属币的真面目为 色。另外一枚是闪闪发光的黄色金属币,它肯定是 币,表面一直未被氧化的原因是 。
(3)不法分子有时用铜锌合金制成假金币行骗。下列方法中能有效鉴别其真假的是 。
A.观察颜色
B.查看图案
C.用手掂量轻重
D.滴一滴硝酸在币的表面,观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下: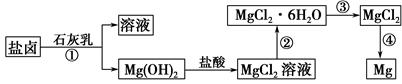
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是 。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图: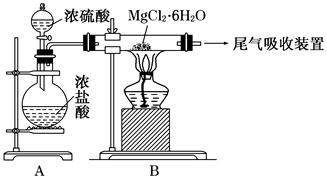
其中装置A的作用是 。
(4)写出过程④中发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
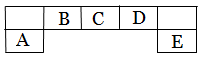
请用化学用语回答下列问题: (1)D元素在周期表中的位置:
(1)D元素在周期表中的位置:
(2)A、D 、E元素简单离子半径由大到小的顺序为_____>______ >______ (填微粒符号 ) (3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式 ,该阳离子中存在的化学键有 。 (5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(6) 化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
(7)在Fe和Cu的混合物中加入一定量C的最高价氧化物的水化物稀溶液,充分反应后,剩余金属m1 g;再向其中加入稀硫酸,充分反应后,金属剩余 m2 g 。下列说法正确的是 。
a.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Cu2+
b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+
c.m1一定大于m2
d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中一定没有单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。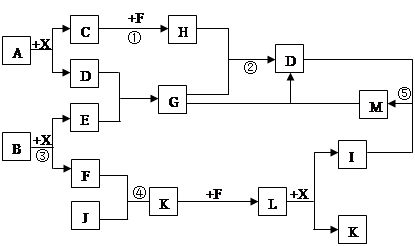
(1)写出化学式:A ,E ,L ;
(2)在反应①②③④⑤中属于氧化还原反应的是 ;
(3)反应③化学方程式为: ;
(4)写出下列离子方程式:反应② ;
G溶液与M溶液的反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B两种常见化合物组成的混合物,其焰色反应均为黄色,其相互转化关系如图(其
他物质均略去)。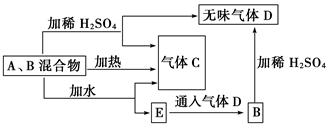
根据以上关系,回答下列问题:
(1)写出A、B、C、D的化学式:A________、B________,C________,D________。
(2)写出混合物中加水反应的化学方程式:_____________________________________
(3)加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为________(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。
上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为
___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com