
【题目】强酸和强碱的稀溶液中和时,中和热为57.3kJ,试计算:
(1)浓度为0.1mol·L-1的NaOH溶液200mL,与足量酸反应时,能放出多少千焦的热量_____?
(2)浓度为5%的H2SO4溶液980g,与足量的NaOH溶液反应,能放出多少热量______ ?
(3)用浓度为0.2mol·L-1的HNO3 100mL,与足量的NaOH溶液反应,能放出多少热量_____ ?
【答案】1.146kJ57.3 kJ1.146 kJ
【解析】
根据中和热的概念写出强酸与强碱发生中和反应的热化学方程式,依据消耗的H+或OH-物质的量计算反应放出的热量。
强酸和强碱的稀溶液中和时,中和热为57.3kJ,则中和热表示的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol。
(1)n(OH-)=n(NaOH)=0.1mol/L![]() 0.2L=0.02mol,与足量酸反应放出的热量为0.02mol
0.2L=0.02mol,与足量酸反应放出的热量为0.02mol![]() 57.3kJ/mol=1.146kJ。
57.3kJ/mol=1.146kJ。
(2)n(H+)=2n(H2SO4)=2![]() 980g
980g![]() 5%
5%![]() 98g/mol=1mol,与足量NaOH溶液反应放出的热量为1mol
98g/mol=1mol,与足量NaOH溶液反应放出的热量为1mol![]() 57.3kJ/mol=57.3kJ。
57.3kJ/mol=57.3kJ。
(3)n(H+)=n(HNO3)=0.2mol/L![]() 0.1L=0.02mol,与足量NaOH溶液反应放出的热量为0.02mol
0.1L=0.02mol,与足量NaOH溶液反应放出的热量为0.02mol![]() 57.3kJ/mol=1.146kJ。
57.3kJ/mol=1.146kJ。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列表述错误的是( )
A.使用新能源,减少化石燃料的燃烧,可防止酸雨的产生
B.明矾在水中能形成胶体,可作为净水剂
C.建设三峡大坝使用了大量水泥,水泥是硅酸盐材料
D.给汽车安装尾气转化装置,易产生光化学烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10﹣5 |
HNO2 | 4.6×10﹣4 |
HCN | 5×10﹣10 |
HClO | 3×10﹣8 |
NH3H2O | 1.8×10﹣5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10﹣10 |
BaCO3 | 2.6×10﹣9 |
CaSO4 | 7×10﹣5 |
CaCO3 | 5×10﹣9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是_____(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为_____。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为_____。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01molL﹣1,则溶液中CO32-物质的量浓度最少应为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一一选修5:有机化学基础]
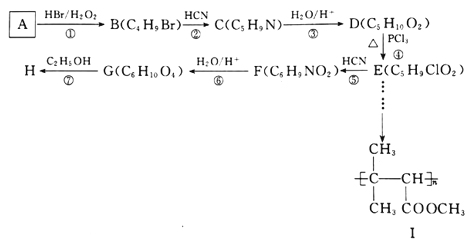
有机物H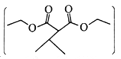 是一种常见的有机合成中间体,在染料、香料、磺酰脲类除草剂等生产中用途广泛,以有机物A为原料合成H的路线如下所示:
是一种常见的有机合成中间体,在染料、香料、磺酰脲类除草剂等生产中用途广泛,以有机物A为原料合成H的路线如下所示:
已知:I. ![]()
II. ![]()
III. 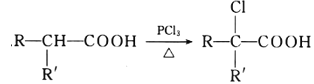
请回答下列问题:
(1)A的化学名称为________________________,分子中共面的原子数最多为_____个。
(2)E分子中所含官能团的名称为________________,②的反应类型为______________。
(3)F的结构简式为_____________________,写出反应⑦的化学方程式:___________________________。
(4)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有_____种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的所有同分异构体的结构简式:_______________________。
(5)设计一条由E到I的合成路线。合成路线示例如下:
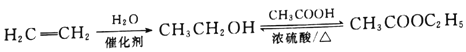
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.01mol某气体的质量为0.44g,该气体的摩尔质量为_______;在标准状况下,该气体的密度是_______
(2)0.3 mol氨气和0.4 mol二氧化碳的质量________(填“相等”或“不相等”,下同),所含分子数________,所含原子数________.
(3) 质量都是50 g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是________,在相同温度和相同压强条件下,体积最大的是________,体积最小的是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量是指单位物质的量的物质所具有的质量,已知NA为阿伏加德罗常数的值,请回答下列问题:
(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
(2)已知一个铁原子的质量为b g,则铁原子的摩尔质量为________。
(3)已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
(4)有以下四种物质:①22 g二氧化碳 ②8 g氢气 ③1.204×1024个氮气分子 ④4 ℃时18 mL水
它们所含分子数最多的是__________,所含原子数最多的是________,质量最大的是________,所含电子数最多的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3mol/L B. Y2为0.4mol/L
C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com