
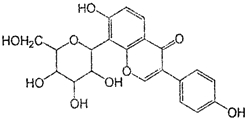
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 该物质在一定条件下能与碳酸氢钠溶液反应 | |
| D. | 一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2 |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、消去和氧化反应,且分子中含有羰基,可发生加成反应,结合有机物的结构特点解答.
解答 解:A.含有酚羟基,可发生取代、氧化和显色反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、消去和氧化反应,故A正确;
B.由结构简式可知有机物的分子式为C21H20O9,故B错误;
C.含有酚羟基,但酸性比碳酸弱,与碳酸氢钠不反应,故C错误;
D.分子中能与氢气发生加成反应的有2个苯环、1个羰基和碳碳双键,则1mol该物质一定条件下最多能消耗H2 8mol,故D错误.
故选A.
点评 本题考查有机物的结构和性质,为高频考点和常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,为解答该题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
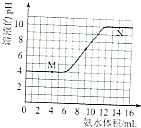 常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )
常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )| A. | 该土壤是酸性土壤 | |
| B. | 当溶液中c(H+)=c(OH-)时,消耗氨水的体积为9mL | |
| C. | M、N点由水电离出的氢离子浓度一定相等 | |
| D. | 将20mL此氨水与10mL同浓度的盐酸混合,充分反应后存在:C(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
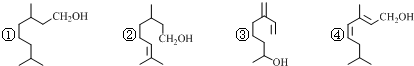
| A. | ①③④互为同分异构体 | |
| B. | ②③④互为同系物 | |
| C. | 上述四种物质中能使酸性KMnO4溶液褪色的只有②③④ | |
| D. | 上述物质分别与足量H2发生加成反应,共可得2种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中将氨基转化成硝基的反应为氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com